抗EGFR单抗治疗局部晚期头颈部鳞状细胞癌临床共识(2023年版)
许婷婷,胡超苏,李宝生
1.中国临床肿瘤学会头颈肿瘤专家委员会;
2.中国医师协会肿瘤放射治疗医师分会
头颈部鳞状细胞癌(squamous cell carcinoma of the head and neck,SCCHN)起源于上皮细胞,常发生于口腔、咽部和喉部等部位[1]。除鼻咽癌外,大部分SCCHN的危险因素与吸烟及饮酒相关,部分口咽癌与人乳头状瘤病毒(human papilloma virus,HPV)感染相关[2]。据统计,2020年全世界范围内唇癌/口腔癌、喉癌、口咽癌和下咽癌的新发病例估计约74万例,死亡病例约36万例[3]。中国国家癌症中心2022年发布的数据显示,中国唇癌/口腔癌、喉癌、口咽癌和下咽癌的新发病例和死亡病例数分别约为7.8万例和4.0万例[4]。
由于病变部位隐蔽,早期症状不典型,大多数SCCHN患者在确诊时已处于局部晚期,单一的治疗手段无法获得令人满意的疗效,通常需要多学科的综合治疗模式[5]。对于无法行根治性手术或有器官功能保留需求的患者,目前的首选治疗是基于标准剂量顺铂的同期放化疗(chemoradiotherapy,CRT)。一项纳入19 805例非转移性SCCHN患者(其中约90%为Ⅲ期或Ⅳ期)的meta分析[6]表明,同期CRT对比单纯放疗5和10年绝对生存获益分别为6.5%(33.6%vs27.1%)和3.6%(20.9%vs17.3%)。然而即便接受了规范治疗,仍有约一半的患者在初次治疗2年内发生复发和(或)转移[2]。另外,CRT相关的近期和远期毒性也不容忽视,在治疗前需要详细评估患者的耐受性,尤其是对于无法耐受标准剂量顺铂治疗的患者,在治疗策略的选择上要兼顾治疗效果、器官毒性和器官功能。
SCCHN 中普遍存在表皮生长因子受体(epidermal growth factor receptor,EGFR)高表达,且与较差的生存预后相关[7]。临床前研究显示,EGFR高表达比低表达的肿瘤具有更强的放射抵抗性[8],加入抗EGFR单抗后可增加放疗的敏感性[9],考虑可能与放疗诱导的细胞凋亡增加有关。此外,抗EGFR单抗可通过影响细胞周期、DNA损伤修复及血管生成等多种途径发挥放疗增敏作用[9-12]。
临床上常用的抗EGFR单抗包括西妥昔单抗、尼妥珠单抗和帕尼单抗等。其中西妥昔单抗是人鼠嵌合型免疫球蛋白G1(immunoglobulin G1,IgG1)抗EGFR单抗,通过与细胞外EGFR特异性结合,竞争性阻断内源性EGFR天然配体,阻碍EGFR二聚体的形成,它还能够通过诱导EGFR内吞使受体数量下调,从而阻止肿瘤细胞内因EGFR激活引起下游相关信号转导通路的活化,抑制肿瘤细胞生长[13-15]。除对EGFR的直接阻断作用外,西妥昔单抗还可以通过抗体依赖的细胞介导的细胞毒作用(antibody-dependent cell-mediated cytotoxicity,ADCC)[16]或促进T细胞的免疫活化等机制发挥抗肿瘤作用[17]。针对局部晚期SCCHN的Ⅲ期研究显示,对比单纯放疗,放疗联合西妥昔单抗可显著改善局部区域控制(locoregional control,LRC),延长总生存期(overall survival,OS)[18-19]。基于这些研究结果,西妥昔单抗在2004年和2006年分别获得欧洲药品管理局(European Medicines Agency,EMA)、美国食品药品管理局(Food and Drug Administration,FDA)的批准,用于与放疗联合治疗局部晚期SCCHN。2022年6月,西妥昔单抗联合放疗治疗局部晚期SCCHN适应证在中国获批[20],是目前唯一获批治疗SCCHN的抗EGFR单抗。尼妥珠单抗是人源型IgG1抗EGFR单抗[21],作用机制与西妥昔单抗类似,2008年在中国获批用于与放疗联合治疗EGFR表达阳性的Ⅲ~ Ⅳ期鼻咽癌[22]。帕尼单抗是全人源的IgG2型抗EGFR单抗,ADCC效应较弱[23],在SCCHN中应用的注册临床试验未取得预期结果,因此目前无相关适应证。
西妥昔单抗与放疗联合的方案为国内局部晚期SCCHN患者提供了有效、低毒的治疗选择。然而,如何在临床工作中合理应用抗EGFR单抗仍面临挑战,包括抗EGFR单抗适用人群的判定标准、应用时机、联合方案的选择及不良事件管理等都需要进一步明确和规范。本共识小组以循证医学证据为基础、相关指南为依据,经充分讨论形成《抗EGFR单抗治疗局部晚期头颈部鳞状细胞癌临床共识(2023年版)》,旨在帮助临床医师合理规范应用抗EGFR单抗治疗局部晚期SCCHN患者,使患者的获益最大化。
《中国临床肿瘤学会(CSCO)头颈部肿瘤诊疗指南(2022年版)》[5]建议局部晚期SCCHN患者采用多学科综合治疗模式。如患者适宜手术,可接受手术治疗并根据术后病理学检查结果决定术后辅助放疗或同期CRT。如患者不适宜手术(包括具有严重合并症、自身原因拒绝手术、肿瘤负荷大预计无法完整切除、手术可能造成重要功能缺失等),可选择同期CRT。放疗联合标准剂量顺铂是目前推荐的同期CRT方案。对于不适宜使用顺铂,即无法耐受标准剂量顺铂治疗的人群,可选择单纯放疗或放疗联合西妥昔单抗治疗。
以顺铂为基础的同期CRT是局部晚期SCCHN首选的非手术治疗策略,其中顺铂在放疗同步期间(100 mg/m2,每3周1次)的累积剂量显著影响预后,一般认为总的累积剂量达到200 mg/ m2是有效剂量[24-26],但受急性和远期毒性的影响,并非所有患者都能耐受这一强度的治疗[27],治疗相关毒性对长期生存患者生活质量的影响值得重视。一项回顾性研究[28]分析了局部晚期SCCHN患者接受CRT的有效性和安全性,发现与接受单纯放疗的患者(n=73)相比,接受同期CRT的患者(n=90)不良反应发生率显著增加,主要包括2~ 3级口腔干燥(92.2%vs37.0%)、3级黏膜炎(74.5%vs50.7%)、3级吞咽困难(82.2%vs47.9%)和3级疼痛(28.9%vs9.6%)等。同样,对于三项美国肿瘤放射治疗协作组(Radiation Therapy Oncology Group,RTOG)研究的合并亚组分析[29]显示,在230例可评估的使用顺铂为基础的同期CRT患者中,99例(43%)患者发生严重的远期毒性。
为降低同期CRT的毒性,有研究曾尝试采用每周1次顺铂方案代替每3周1次顺铂方案。在印度的非劣效性Ⅲ期随机对照研究[30]中,顺铂30 mg/m2单周方案组(n=150)的估计2年LRC率显著低于标准的3周方案组(顺铂100 mg/ m2,每3周1次;
n=150)(58.5%vs73.1%,P=0.014)。另一项印度研究[31]发现,单周剂量提高到40 mg/m2后2年LRC率可获得与3周方案(顺铂100 mg/m2,每3周1次)类似的结果(52.6%vs47.4%)。然而,由于该研究中患者所接受的放疗技术比较落后,70%以上均为钴-60照射,因此该研究的证据级别仍值得商榷。
考虑到顺铂(100 mg/m2)每3周用药仍为标准方案,而药物剂量和频率的调整可能削减疗效,因此在局部晚期SCCHN患者接受同期CRT前,建议对患者进行顺铂治疗的耐受性和治疗毒性的评估,尽早识别不宜使用标准剂量顺铂治疗的患者,进而使临床决策更加合理。2016年由亚太地区头颈部肿瘤专家讨论形成的共识意见[32]对不宜使用顺铂治疗的人群进行了定义。参考该意见,本共识专家组经讨论认为,如果患者存在以下情况则为不宜使用标准剂量顺铂治疗的人群:①美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体力状态(performance status,PS)评分≥2;
② 肾功能不全,内生肌酐清除率(creatinine clearance,Ccr)值<50 mL/min;
③≥2级神经病变或听力损伤/耳鸣;
④ 心功能不全,纽约心脏病协会(New York Heart Association,NYHA)心功能分级≥Ⅱ级;
⑤ 对铂类药物过敏。此外,对于存在以下任意一项高危因素的患者,建议使用顺铂治疗时需谨慎:①年龄>70岁;
② ECOG PS评分≥1;
③患者主观整体评估法(Patient-Generated Subjective Global Assessment,PG-SGA)评分≥3分;
④ 肾功能不全,Ccr值为50~ 60 mL/min;
⑤ 1级神经病变或听力损伤/耳鸣;
⑥ 心功能不全,NYHA心功能分级Ⅰ级,左心室射血分数(left ventricular ejection fraction,LVEF)≤50%;
⑦ 人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染和获得性免疫缺陷综合征(acquired immunodeficiency syndrome,AIDS)CD4+T淋巴细胞计数<200 个/ μL;
⑧ 既往铂类(包括诱导化疗)药物治疗(累积剂量 ≥200 mg/m2)。尤其对于存在≥2条上述高危因素的患者应考虑避免使用标准剂量顺铂治疗(表1)。

表1 局部晚期SCCHN中不宜使用标准剂量顺铂治疗和需谨慎使用顺铂治疗人群的判定标准
专家意见 1:建议在CRT前评估患者对标准剂量顺铂治疗的耐受性和治疗毒性。不宜使用标准剂量顺铂治疗的人群为:ECOG评分≥2;
Ccr<50 mL/min;
存在≥2级神经病变或听力损伤/耳鸣;
NYHA心功能分级≥Ⅱ级;
对铂类药物过敏。对于存在≥2条高危因素的患者也应避免使用标准剂量顺铂治疗。
Bonner等[18]的随机Ⅲ期临床研究对比了Ⅲ、Ⅳ期[1998 年美国癌症联合委员会(American Joint Committee on Cancer,AJCC)分期系统]SCCHN患者(口咽癌、喉癌和下咽癌)接受放疗联合西妥昔单抗(n=211)及单纯放疗(n=213)的疗效,发现放疗联合西妥昔单抗可显著改善中位LRC时间(24.4个月vs14.9个月,P=0.005),并延长患者中位OS(49.0个月vs29.3个月,P=0.030)。长期随访[19]发现,放疗联合西妥昔单抗组患者的生存率更高,两组患者5年OS率分别为45.6%和36.4%,安全性方面,放疗联合西妥昔单抗的毒性可控,并未明显增加口腔黏膜炎、放射性皮炎和吞咽困难等的发生率及持续时间,患者依从性较高,未对患者生活质量造成不良影响,并且在接受西妥昔单抗治疗的患者中,出现≥2级皮疹者的OS显著优于未出现皮疹或1级皮疹者(P=0.002)。
一项基于美国国立癌症研究所旗下的监测、流行病学和最终结果(Surveillance,Epidemiology,and End Results,SEER)数据库的回顾性研究[33],在1 335例接受放疗的局部晚期SCCHN患者中,比较了放疗期间同步使用高剂量顺铂(≥200 mg/m2,n=264)、低剂量顺铂(30~ 40 mg/m2或更低,n=259)或卡铂(n=353)的生存结果,发现低剂量顺铂及卡铂组患者的OS均劣于高剂量顺铂组。日本的回顾性研究[34]在不适合顺铂治疗的局部晚期SCCHN患者中,比较了放疗联合卡铂(n=29)或放疗联合西妥昔单抗(n=18)的疗效和安全性,结果显示,卡铂和西妥昔单抗组的3年LRC率分别为56%和58%(P=0.740),中位OS分别为91.9和35.5个月(P=0.380),差异均无统计学意义,但卡铂联合放疗组3~ 4级血液学毒性发生率更高(中性粒细胞减少34%,贫血28%,血小板减少28%),而西妥昔单抗组仅发生1例 贫血。
CONCERT-2试验[35]是一项多中心随机(2∶3)对照Ⅱ期研究,在151例接受治疗的Ⅲ~ Ⅳb期SCCHN患者中,对比放疗联合标准剂量顺铂(100 mg/m2,每3周1次)(n=61)和放疗联合帕尼单抗(n=90)的疗效和安全性。结果显示,两组2年LRC率差异无统计学意义(61%vs51%,P=0.06),最常见的3~ 4级不良事件发生率在放疗联合标准剂量顺铂组为40%,放疗联合帕尼单抗组为42%,两组的严重不良反应发生率分别为40%和34%,提示帕尼单抗联合放疗相比放疗联合标准剂量顺铂并不能带来更多获益。
对于经评估不考虑使用标准剂量顺铂治疗的患者,可以选择放疗联合西妥昔单抗或卡铂作为替代方案。
HPV阳性口咽癌是预后较好的口咽癌亚型[36],有研究尝试予以低强度治疗来减轻毒性,提高患者长期生活质量。其中在根治性放疗中替代高剂量顺铂化疗是研究方向之一,如采用西妥昔单抗替代高剂量顺铂与放疗联合用于HPV阳性口咽癌。然而,相关研究并未达到预期终点。RTOG 1016[37]是一项随机、多中心、非劣效研究,纳入了805例HPV阳性的口咽癌患者,旨在证明放疗联合西妥昔单抗(n=399)与放疗联合顺铂(n=406)相比,能否在减少毒性的同时不降低疗效,中位随访4.5年,放疗联合西妥昔单抗未能达到预设的非劣效界值[风险比(hazard ratio,HR)=1.45,非劣效标准为HR=1.4]。另一项放疗联合顺铂或西妥昔单抗治疗低危HPV阳性口咽癌患者(De-ESCALaTE HPV)的研究[38]也获得了类似结论,即接受标准同期CRT(顺铂100 mg/m2,每3周1次)治疗的患者中位OS和无进展生存期(progressionfree survival,PFS)均优于放疗联合西妥昔单抗的患者。在Trans-Tasman放射肿瘤学组(Trans-Tasman Radiation Oncology Group,TROG)的一项研究(TROG 12.01)[39]中,每周1次顺铂(40 mg/m2)同步放疗的效果仍然优于西妥昔单抗联合放疗。进一步分析CD103表达水平与HPV阳性口咽癌患者预后相关性的研究[40]表明,在接受西妥昔单抗联合放疗(n=145)的患者中,CD103高表达组(≥30%,n=44)组的3年无失败生存率(failure-free survival,FFS)显著高于CD103低表达组(<30%,n=101)(92%vs74%,P<0.001),3年OS率(100%vs86%,P<0.001)也更高;
而在接受顺铂联合放疗的患者(n=144)中,未发现CD103表达水平与预后的相关性。因此,在CD103高表达的HPV阳性口咽癌患者中抗EGFR靶向治疗的价值有待进一步探索。目前尚无HPV阴性口咽癌的大样本研究,因此治疗方面同SCCHN。
HPV阳性口咽癌根治性放疗期间尚无证据显示可以用抗EGFR单抗替代标准剂量顺铂。
此外,也有一些Ⅲ期随机对照研究旨在探索在同期CRT的基础上加用抗EGFR单抗可使患者获益。RTOG-0522研究[41]纳入895例局部晚期SCCHN患者(T2N2-3M0或T3-4,任何N,M0),随机接受同期CRT(加速分割放疗:72 Gy/42次,6周完成,其中第1~ 12天为每天2次照射;
顺铂100 mg/m2,第1、22天)或在CRT基础上联合西妥昔单抗治疗,两组完成2个周期顺铂的比例均超过90%,但西妥昔单抗组无生存优势[两组患者的3年PFS率(61.2%vs58.9%;
P=0.76)、3年OS率(72.9%vs75.8%;
P=0.32)差异均无统计学意义],且联合西妥昔单抗显著增加了3~ 4级口腔黏膜炎(43%vs33%,P=0.002)和照射野内皮炎(25%vs15%,P<0.001)的发生率。该研究进一步分析发现,KRAS突变患者能够从联合西妥昔单抗的治疗中获益,第1年PFS(HR=0.31,95% CI:0.10~ 0.94,P=0.040)和1~ 2年OS率(HR=0.19,95% CI:0.04~ 0.86,P=0.030)均有改善[42]。国内一项针对T4b期下咽癌的小样本回顾性研究[43]的多因素分析显示,使用抗EGFR单抗治疗的患者OS更优,但是该组患者治疗的异质性较大,结论还有待前瞻性研究的证实。一项印度的Ⅲ期随机研究[44]表明,与放疗同步顺铂30 mg/m2的周方案相比,在CRT基础上联合尼妥珠单抗组的PFS有所改善(HR=0.69,95% CI:0.53~ 0.89,P=0.004),但OS差异无统计学意义(HR=0.84,95% CI:0.65~ 1.08,P=0.163),而尼妥珠单抗组的黏膜炎发生率更高(66.7%vs55.8%,P=0.010),但该研究采用了非标准剂量的顺铂同步化疗作为对照,因而CRT组3年PFS率仅为45.8%,明显低于以往的对照研究,因此解读研究结果需要谨慎。一项Ⅱ期随机研究(CONCERT-1)[45]同样尝试在CRT(顺铂100 mg/m2,每3周1次)基础上联合帕尼单抗治疗局部晚期SCCHN,结果显示,2年LRC率未见明显提高(68%vs61%),且帕尼单抗的加入增加了毒性。基于上述研究结果,不常规推荐同期CRT期间联合抗EGFR单抗治疗。
放疗联合西妥昔单抗可作为经诱导化疗后出现顺铂相关毒性患者的治疗选择。由于多西他赛+顺铂+5-氟尿嘧啶(TPF)诱导化疗方案可能引起严重不良反应,后续再进行联合顺铂的同期CRT可能会导致顺铂毒性累积,因此部分研究探讨了诱导化疗后的根治方案的优化。《中国临床肿瘤学会(CSCO)头颈部肿瘤诊疗指南(2022年版)》[5]指出,考虑到顺铂的累积毒性,在使用以顺铂为基础的诱导治疗后,不推荐再使用标准剂量顺铂的同期化疗方案。意大利的一项研究[46]显示,在同步治疗(CRT或放疗联合西妥昔单抗)前加用TPF诱导化疗可以改善患者生存情况,包括和不包括诱导化疗组患者的中位OS分别为54.7和31.7个月(P=0.031),中位PFS分别为30.5和18.5个月(P=0.013)。亚组分析显示,诱导化疗后同步联合西妥昔单抗获益趋势更大,推测西妥昔单抗可能对经铂类药物诱导化疗后残留的耐药肿瘤细胞具有更好的增敏作用[46]。另一项研究[47]在153例初治Ⅲ或Ⅳ期喉癌/下咽癌患者中比较了TPF诱导化疗后放疗同期联合顺铂和放疗同期联合西妥昔单抗的疗效和安全性。结果发现,两组3个月时的保喉率相近,分别为93%和95%。该研究的长期随访结果表明,两组的5年OS率差异无统计学意义(66.6%vs66.9%,P=0.900),但放疗同期联合西妥昔单抗组患者有更好的耐受性和手术挽救成功率(最后1次评估时,放疗联合西妥昔单抗组局部复发后手术成功的患者有6例,而顺铂组为0例)[48]。
因此,经诱导治疗后,如肿瘤达到完全或部分缓解,后续可选择单纯放疗或放疗联合西妥昔单抗治疗,如未达到可考虑手术治疗。
专家意见2:放疗同步联合标准剂量顺铂是包括HPV阳性口咽癌在内的标准非手术治疗。CRT联合抗EGFR单抗不作为常规推荐。对于无法耐受标准剂量顺铂的患者,或在接受TPF诱导化疗后出现顺铂相关毒性的患者,可选择放疗联合西妥昔单抗方案。
欧洲癌症治疗与研究组织(European Organization for Research and Treatment of Cancer,EORTC)24971(TAX 323)和TAX 324研究[49-50]确立了TPF方案成为局部晚期SCCHN的标准诱导化疗方案,但TPF诱导化疗并未在CRT基础上进一步改善生存。Haddad等[51]的研究显示,TPF方案序贯CRT对比单纯CRT未提高OS率,且诱导化疗组中性粒细胞缺乏伴发热的患者更多。之后另两项类似的Ⅲ期研究[52-53]也未能证实诱导化疗在局部晚期SCCHN中的价值,且TPF三药联合方案的毒性如骨髓抑制、胃肠道反应等需引起关注。
但诱导治疗在缩瘤、降期及保喉方面的优势得到多项早期研究[26,54-57]的证实,且TPF方案比PF方案在患者生存方面更有优势[49-50]。在RTOG 91-11研究[57]中,诱导化疗联合放疗(诱导化疗组,n=173)与同步CRT(CRT组,n=172)均较单纯放疗(单纯放疗组,n=173)显著改善无喉切除生存率,而诱导化疗组和CRT组间OS差异无统计学意义,但长期随访发现CRT组非癌症相关的死亡率高于诱导化疗组(10年时分别为69.8%和52.8%,P=0.030)。因此,尽管同期CRT仍是局部晚期SCCHN的标准非手术治疗手段,但其远期毒性也需要引起关注,诱导治疗在综合治疗中的意义仍然值得肯定,尤其是通过优化诱导治疗方案来降低毒性、提高缓解率是研究的重点。
2010年,美国匹兹堡大学的一项小样本研究[58]在诱导化疗方案(多西他赛+顺铂)中加入西妥昔单抗(TPE方案),发现患者可获得长期生存和良好的安全性。后续多项研究陆续证实含西妥昔单抗的诱导治疗方案对于局部晚期SCCHN患者是一种有效且毒性较低的方案。一项德国研究[59]在起初入组的Ⅲ/Ⅳ期喉咽癌患者中比较了TPF±西妥昔单抗诱导方案,希望获得更好的诱导应答率,从而增加保喉患者的比例,研究过程中因毒性问题(64例患者中出现4例治疗相关死亡)而更改方案,后续112例入组患者不再接受5-氟尿嘧啶治疗,方案调整为TP对比TPE,显示两种方案的无喉切除生存率和OS率相似,但TPE方案毒性更低,诱导治疗相关死亡更少。奥地利的一项头对头比较研究[60]结果表明,TPE与TPF方案3个月的客观缓解率差异无统计学意义(74.5%vs63.3%,P=0.109),治疗400 d后的OS率(86.1%vs78.5%)和PFS率(70.0%vs66.5%)接近,TPE组严重不良反应发生率低,证实了在诱导治疗中用西妥昔单抗代替5-氟尿嘧啶的可行性。
因此,在诱导治疗中,对于无法耐受5-氟尿嘧啶毒性的患者,可用西妥昔单抗代替5-氟尿嘧啶,选择TPE作为诱导治疗方案。
专家意见3:对于拟行诱导治疗的局部晚期SCCHN患者,目前的标准诱导方案为TPF,在无法耐受5-氟尿嘧啶毒性的患者中,TPE也是可选择的诱导治疗方案。
早期预防、早期识别和及时干预是管理不良反应的总体原则。早期预防应在开始治疗之前进行,以患者宣教和治疗前评估为主,引导患者对不良反应建立正确的认知和有效防护的意识。早期识别要求医师和患者在治疗过程中主动监测相关反应,并进行鉴别诊断,如确认则要及时干预,实施个体化治疗。
6.1 痤疮样皮疹
研究[61-62]发现,应用西妥昔单抗治疗后,超过80%的患者会出现特征性皮肤不良反应,如痤疮样皮疹、甲沟炎、皮肤干燥和瘙痒、黏膜炎等。其中,痤疮样皮疹最为常见,发生率为60%~ 80%,大多数表现较轻[62]。痤疮样皮疹可在开始治疗后2 d~ 6周内出现,停止治疗1个月后消退。痤疮样皮疹主要表现为红色毛囊性丘疹和脓疱,应注意与普通痤疮鉴别。治疗前的风险评估包括患者是否存在任何暴露于抗EGFR治疗后可能恶化的先前存在的皮肤病,如牛皮癣、粉刺、红斑痤疮、特应性皮炎、严重干燥症、鱼鳞病和湿疹。主动干预包括:避免穿紧身鞋和衣服;
避免直接暴露在阳光下;
避免接触可能导致皮肤干燥的产品(如烫水、含乙醇的化妆品);
避免胡须过长,定期剃须,事先涂抹剃须膏,之后使用润肤剂和保湿须后水;
用洁面乳和温水卸妆;
正确剪指甲等。
根据皮疹严重度分级进行针对性治疗及调整西妥昔单抗治疗剂量:①1级皮疹[<10%体表面积(body surface area,BSA),伴或不伴瘙痒和触痛]无需调整药物剂量或停药,可不予处理或局部外用红霉素软膏等抗生素类药物。② 2级皮疹(10%~ 30%BSA,伴或不伴瘙痒和触痛;
或丘疹/脓疱累及范围>30%BSA,但症状轻微者)无需调整药物剂量或停药,可局部外用抗生素、1~ 2周中效糖皮质激素等药物,直到皮疹消退至1级,如病变以丘疹为主时无需全身治疗,如以脓疱为主时可服用米诺环素100 mg/ d,多西环素100 mg/d,连续服药≥4周,直至症状消退,脓疱皮疹消退同时皮疹消退至1级可以恢复西妥昔单抗治疗。③3~ 4级皮疹(3级:丘疹/脓疱累及范围>30%BSA,且伴中到重度症状;
4级:危及生命)需暂停西妥昔单抗治疗,同2级皮疹进行针对性治疗,待皮疹改善至2级可重新开始西妥昔单抗治疗(250 mg/m2),如果皮疹再次出现,则相应将西妥昔单抗剂量减量50 mg/ m2,第3次出现3级以上皮疹,需等待恢复至2级,西妥昔单抗剂量再减量50 mg/m2,如果皮疹仍反复出现,则需永久停用西妥昔单抗,推荐剂量调整方案见表2[62-64]。④ 4级皮疹需永久停用靶向治疗药物,收治入院,进行皮损处病原生物学培养并开始系统性使用抗生素±糖皮质激素治 疗[62-64]。
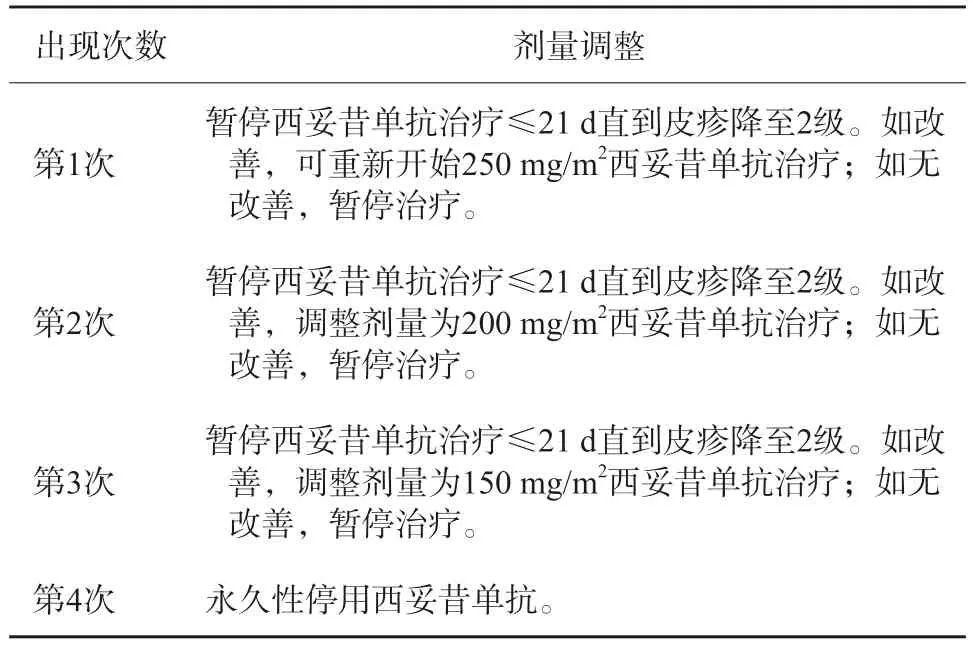
表2 放疗联合西妥昔单抗治疗局部晚期SCCHN期间诱发丘疹脓疱型皮疹(3级)的剂量调整方案
6.2 口腔黏膜炎
口腔黏膜炎是放疗相关的常见急性毒性反应。在接受放疗的头颈癌患者中,口腔黏膜炎的发生率在80%以上[65-66],其中在接受同期CRT的患者中发生率更高[65]。传统放疗技术联合西妥昔单抗并不显著增加口腔黏膜炎的发生率[18],而接受调强放疗时,暴露于低剂量照射的正常口腔黏膜范围扩大,联合抗EGFR单抗可能增加黏膜对低剂量放射线的敏感性。
放疗前应做好患者宣教工作,加强患者对CRT不良反应的认知,指导其做好相关不良反应的心理准备,在治疗前和治疗中做好皮肤和口腔等护理工作。建议每天检查口腔黏膜,及时消除可引起损伤的隐患,如不合适的义齿等。多饮水或使用人工唾液保持口腔湿润,可短期使用唇膏滋润口唇。每天4~ 6次采用柔软牙刷、含氟牙膏、牙线及不含乙醇的生理盐水或碱性漱口水清洁口腔[67-68]。如装有金属牙,可在金属牙和口腔黏膜之间填充保护材料以减小摩擦。
放疗期间建议患者戒烟、戒酒,多饮水,避免热性、酸性及辛辣食物[67]。金银花饮剂有助于口腔黏膜炎的恢复,可适当服用。在药物预防和治疗方面,可选择非甾体类抗炎药、锌补充剂、利多卡因漱口水、阿片类药物、口腔黏膜保护剂、生长因子及细胞因子类药物等,如继发感染则应进行局部或全身抗感染治疗[69-71]。不推荐全身使用黏膜保护剂。在口腔黏膜损伤愈合前,尽量少带义齿。如在联合西妥昔单抗时出现3~ 4级口腔黏膜炎,需暂停西妥昔单抗治疗直至黏膜反应降至2级或以下[72],必要时暂停放疗。
6.3 放射性皮炎
放射性皮炎是放疗过程中常见的皮肤不良反应。与单纯放疗或CRT相比,放疗联合西妥昔单抗相关皮炎出现时间更早、程度更严重,一般在治疗开始后1~ 2周内出现,并在治疗结束后1~ 2周内消退[73]。鉴于西妥昔单抗联合放疗相关皮炎与放疗/CRT相关皮炎有所差别,一项欧洲专家共识对放疗联合西妥昔单抗相关皮炎提出了分级和管理意见(表3)[73]。

表3 基于欧洲专家共识的放疗联合西妥昔单抗相关放射性皮炎的分级管理建议
专家意见4:根据放疗联合西妥昔单抗相关不良反应进行分级管理,1~ 2级经积极对症处理后可继续治疗,3~ 4级需暂停西妥昔单抗治疗直至不良反应降至2级以下,必要时暂停放疗。
7.1 免疫检查点抑制剂
近年来,多种针对程序性死亡[蛋白]-1(programmed death-1,PD-1)/程序性死亡[蛋白]配体-1(programmed death ligand-1,PDL1)的免疫检查点抑制剂在复发转移SCCHN中的疗效已经获得肯定[74-75],而在CRT或根治性放疗中加用免疫检查点抑制剂能否为局部晚期SCCHN患者带来获益成为近年来的研究热点之一。遗憾的是,已公布的两项免疫检查点抑制剂联合CRT的Ⅲ期临床研究(JAVELIN H&N-100[76]和KEYNOTE-412[77])均未达到研究的主要终点。KEYNOTE-412研究[77]显示,帕博利珠单抗联合CRT与安慰剂联合CRT的2年无事件生存率(主要终点)分别为63.2%和56.2%,差异无统计学意义(HR=0.83,95% CI:0.68~ 1.03,P=0.043,未达到优效性阈值)。此外,有研究在根治性放疗中同步西妥昔单抗和PD-1/PD-L1单抗治疗,期望能为局部晚期SCCHN患者,尤其是为不能耐受标准剂量顺铂的患者提供一种低毒、有效的选择,然而前期的探索结果令人失望。Ⅲ期GORTEC-REACH研究[78]针对不适合铂类药物治疗的局部晚期SCCHN患者队列,在西妥昔单抗+放疗的基础上联合PD-L1单抗阿维鲁单抗,发现未显著提高患者的2年PFS率(P=0.15)(主要研究终点),且在LRC、远处转移方面也无优势,而在适合铂类药物治疗的队列中,放疗+西妥昔单抗+阿维鲁单抗的方案因中期分析达到无效终点而提前终止。DUCRO研究[79]是一项开放标签、多中心的单臂Ⅰ/Ⅱ期研究,在PD-L1联合阳性评分(combined positive score,CPS)>1的局部晚期SCCHN中评估了抗PD-L1单抗德瓦鲁单抗联合放疗和西妥昔单抗方案的疗效,主要终点是2年PFS率,但研究因为监管问题提前终止。前期公布的数据显示,在中位随访11.5个月时,入组患者(6/9)的1和2年PFS率分别为77.7%和58.3%,但研究样本量太小,该方案的有效性尚需进一步考证[80]。因此,目前在局部晚期SCCHN根治性放疗同步采用抗EGFR单抗+PD-1/PD-L1单抗的价值仍不明确。
此外,也有Ⅰb期研究[81]探索在西妥昔单抗联合放疗方案中加入细胞毒性T淋巴细胞相关抗原4(cytotoxic T lymphocyte associated antigen-4,CTLA-4)抑制剂伊匹木单抗对Ⅲ~ ⅣB期SCCHN的毒性和最佳联合剂量,初步证实了在西妥昔单抗联合放疗的基础上加用伊匹木单抗的安全性,有待后续的Ⅱ期研究结果。
7.2 放疗增敏剂
除西妥昔单抗外,另一种在Ⅲ期临床试验中证实有效的放疗增敏药物是尼莫拉唑(nimorazole)。尼莫拉唑是一种可靶向乏氧肿瘤细胞的放疗增敏药物。来自丹麦的一项Ⅲ期研究[82]表明,尼莫拉唑联合放疗可显著提高声门上型喉癌和口咽癌患者的LRC率。目前尼莫拉唑仅在丹麦获批。此外,xevinapant是一种口服的抗凋亡蛋白抑制剂,具有良好的放疗增敏效果,曾获美国FDA突破性疗法认定,用于与标准化疗及放疗方案联合治疗初治无法切除的局部晚期SCCHN,在Ⅱ期随机研究[83]中,xevinapant联合标准CRT显示出更优的疗效,目前Ⅲ期TrilynX研究[84]正在开展,期待未来xevinapant与抗EGFR单抗联合应用于放疗增敏的临床实践。
以标准剂量顺铂为基础的同期CRT是局部晚期SCCHN患者的标准非手术治疗模式。但也应注意CRT的毒性和耐受性。与单纯放疗相比,西妥昔单抗联合放疗可显著提高局部晚期SCCHN患者的生存率。本共识建议,对于无法耐受标准剂量顺铂的患者,可选择放疗联合西妥昔单抗的方案。对于有缩瘤、降期或器官功能保留需求、拟行诱导治疗的患者,标准诱导治疗方案为TPF,对于不能耐受TPF毒性的患者,可用西妥昔单抗替代5-氟尿嘧啶,采用TPE方案。考虑到顺铂的累积毒性,在使用含顺铂诱导治疗后,不推荐再使用标准剂量顺铂的同期化疗方案,诱导治疗后肿瘤退缩良好的,后续可选择单纯放疗或放疗联合西妥昔单抗治疗。对于放疗联合西妥昔单抗的相关不良反应,可以通过治疗前预防、治疗过程中早期识别和及时干预进行全面、分级管理。
利益冲突声明:所有作者均声明不存在利益冲突。
《抗EGFR单抗治疗局部晚期头颈部鳞状细胞癌临床共识(2023年版)》 专家组
顾 问:
李宝生 山东第一医科大学附属肿瘤医院
组 长:
胡超苏 复旦大学附属肿瘤医院
副组长:
郭 晔 同济大学附属东方医院
陈晓钟 浙江省肿瘤医院
林少俊 福建省肿瘤医院
易俊林 中国医学科学院肿瘤医院
执笔人:
许婷婷 复旦大学附属肿瘤医院
编 委(以姓名汉语拼音字母为序):
白春梅 北京协和医院
董 频 上海交通大学医学院附属第一人民医院
冯 梅 四川省第三人民医院
高 劲 中国科学技术大学附属第一医院
韩 非 中山大学肿瘤防治中心
韩亚骞 湖南省肿瘤医院
何 侠 江苏省肿瘤医院
胡广原 华中科技大学同济医学院附属同济医院
李 光 中国医科大学附属第一医院
陆雪官 复旦大学附属肿瘤医院
任国欣 上海交通大学医学院附属第九人民医院
石 梅 空军军医大学西京医院
孙 艳 北京大学肿瘤医院
陶 磊 复旦大学附属眼耳鼻喉科医院
王佩国 天津医科大学肿瘤医院
王孝深 复旦大学附属眼耳鼻喉科医院
杨坤禹 华中科技大学同济医学院附属协和医院
张欣欣 解放军总医院第一医学中心
朱国培 上海交通大学医学院附属第九人民医院
朱小东 广西医科大学附属武鸣医院、广西医科大学附属肿瘤医院
猜你喜欢西妥单抗毒性FOLFOXIRI联合贝伐单抗±阿替利珠单抗治疗转移性结直肠癌实用肿瘤学杂志(2022年3期)2022-11-30司库奇尤单抗注射液皮肤性病诊疗学杂志(2020年4期)2020-09-02西妥昔单抗在转移性结直肠癌一线治疗后的后续应用研究进展中国癌症杂志(2020年1期)2020-01-13动物之最——毒性谁最强小哥白尼(野生动物)(2019年5期)2019-08-27苦豆子总碱对PC12细胞的毒性中成药(2018年11期)2018-11-24使用抗CD41单抗制备ITP小鼠的研究中国卫生标准管理(2015年16期)2016-01-20EGFR表达与放疗抵抗的关系及西妥昔单抗用于直肠癌术前放疗增敏的研究进展医学研究杂志(2015年11期)2015-06-10西妥昔单抗联合IMRT同步化疗治疗晚期鼻咽癌的疗效观察西南国防医药(2015年7期)2015-02-28吸入麻醉药的作用和毒性分析养殖与饲料(2014年10期)2014-02-28西妥昔单抗联合NP方案治疗晚期NSCLC的疗效观察河南医学研究(2014年4期)2014-02-27- 范文大全
- 说说大全
- 学习资料
- 语录
- 生肖
- 解梦
- 十二星座
-
主题党日活动交流发言8篇
主题党日活动交流发言8篇主题党日活动交流发言篇13月13日,东城区党史学习教育动员大会召开。市委
【活动总结】 日期:2022-12-23
-
2022年4月主题党日活动记录范文15篇
2022年4月主题党日活动记录范文15篇2022年4月主题党日活动记录范文篇1一个崇尚阅读的民族,必然精神饱满、意气风发、活力四射。习近平总书记强调:“学习
【活动总结】 日期:2022-08-01
-
家乡赋|最美的家乡赋
家乡赋 孙传志 今安康市,白河双丰镇,吾之家乡也。三环沃土,山水环抱。其北依山,山系五岭,山
【调研报告】 日期:2020-04-01
-
少先队的光荣历史故事 队前教育-光辉历程
2017-2018学年队前教育1光辉历程一、劳动童子团1924——1927二、三十年代年的中国是一个
【法律文书】 日期:2020-06-23
-
党支部1-12月全年主题党日活动计划表
2022年党支部主题党日活动计划表序号活动时间活动方式活动内容12022年1月专题学习研讨集中观看2022年新年贺词,积极开展学习研讨交流。组织生活会组织党员认真对照党章...
【活动总结】 日期:2022-10-14
-
【人教版1-6年级数学上册知识点精编】1-6年级数学人教版教材
人教版二年级数学上册知识点汇总第一单元长度单位一、米和厘米1、测量物体的长度时,要用统一的标准去测量
【调研报告】 日期:2020-11-08
-
2022年2月份主题党日活动记录5篇
2022年2月份主题党日活动记录5篇2022年2月份主题党日活动记录篇1尊敬的党组织:在今年的开学初,本人积极参加教研室组织的教研活动,在学校教研员的指
【活动总结】 日期:2022-08-12
-
医院最佳主题党日活动11篇
医院最佳主题党日活动11篇医院最佳主题党日活动篇1 医院最佳主题党日活动篇2为隆重纪念中国共产党成立100周年,进一步巩固党的群众路线教育实践活动成果,切实
【活动总结】 日期:2022-10-29
-
2023年平安校园建设方案13篇
平安校园建设方案“平安校园”创建工作,我们幼儿园全体教职员工一直把它当作头等大事来抓。领导高度重视,以“平安校园”创建活动为抓手,建立和规范校园安全工作机制
【规章制度】 日期:2023-11-02
-
主题党日活动记录202210篇
主题党日活动记录202210篇主题党日活动记录2022篇12021年是中国共产党成立100周年,为广泛开展爱国主义宣传教育,铭记党的历史,讴歌党的光辉历程,
【活动总结】 日期:2022-08-02
-
正式的晚宴邀请函 公司晚宴邀请函
尊敬的先生 女士: 我公司谨定于xxxx年xx月xx日xx:xx在xxxx店隆重举行xx市xx届xxxx晚宴(宴会地址:xx区xx路xxxx) 敬请届时光临!xxxxxx集团股份有限公司xxxx有限公司敬邀xxxx年xx月xx日
【简历资料】 日期:2019-08-03
-
一年级新学期目标简短_一年级学生新学期打算
新学期到了,我是一年级下册的小学生了。 上课的时候,我要认真学习,不做小动作,认真听讲。我要认真学习,天天向上,努力学习,耳朵要听老师讲课,眼睛要瞪得大大的看老...
【简历资料】 日期:2019-10-26
-
《国行公祭,为佑世界和平》课文原文阅读_国行公祭为佑世界和平每段段意
国行公祭,为佑世界和平钟声“国行公祭,法立典章。铸兹宝鼎,祀我国殇。”侵华日军南京大屠杀遇难同胞纪念
【简历资料】 日期:2020-11-28
-
[信访复查复核制度作用探讨]信访复查复核有用吗
作为我国特有的一项制度,信访制度的出现并长期存在不是偶然的,虽然一些法学专家认为信访制度具有“人治”
【职场指南】 日期:2020-02-16
-
[党员干部2019年主题教育个人问题检视清单及整改措施2篇] 党员干部
2019年主题教育问题检视清单及整改措施根据主题教育领导小组办公室《关于认真做好主题教育检视问题整改
【求职简历】 日期:2019-11-08
-
网络维护工作内容_(精华)国家开放大学电大专科《网络系统管理与维护》形考任务1答案
国家开放大学电大专科《网络系统管理与维护》形考任务1答案形考任务1理解上网行为管理软件的功能【实训目
【职场指南】 日期:2020-07-17
-
红旗颂朗诵稿原文【《红旗颂》朗诵词】
《红旗颂》朗诵词 女:晴空万里,红旗飘扬, 六十载风云,我们昂首阔步。 男:六十个春秋,
【职场指南】 日期:2020-02-16
-
党委会与局长办公会的区别_局长办公会制度
为进一步加强xxx局工作的规范化、制度化建设,提高行政效能,规范议事程序,特制定本制度。一、会议形式1、局长办公会议由局长、副局长参加。由局长召集和主持。根据工作需要...
【求职简历】 日期:2019-07-30
-
《铁拳砸碎“黑警伞”》警示教育片观后感
影片深刻剖析了广西北海市公安局海西派出所原所长张枭杰蜕变堕落的轨迹。观看警示教育片后,做为一名党员教
【简历资料】 日期:2020-08-17
-
如何凝心聚力谋发展【坚定信心谋发展凝心聚力促跨越】
当前,清河正处于在苏北实现赶超跨越基础上全面腾飞的战略机遇期,处于在全市率先实现全面小康基础上率先实
【简历资料】 日期:2020-03-17
-
【2021我和祖国共成长征文演讲稿】
我和祖国共成长征文演讲稿我与祖国同成长1敬爱的老师,亲爱的同学:大家好!我是二道沙河小学五年级二班的
【汇报体会】 日期:2021-04-11
-
财政资金监管情况 [加强财政资金监管夯实乡财市管基础]
xx市地处湖南省几何中心,总面积1897平方公里,总人口113万,其中农业人口98万,辖19个乡镇、
【导游词】 日期:2020-03-30
-
食品安全经营承诺书
食品安全经营承诺书 为了认真贯彻执行《中华人民共和国食品安全法》,维护消费者餐饮消费的权益及食品安
【礼仪】 日期:2021-11-03
-
联合肤色分割的Adaboost算法人脸快速检测
◆徐凌风(中国人民公安大学北京100038)人脸检测技术作为计算机视觉中的重要一环,被广泛应用于各行
【其他范文】 日期:2023-01-12
-
贯彻落实中央八项规定情况汇报 贯彻落实中央八项规定精神专题会议上的讲话
贯彻落实中央八项规定精神专题会议上的讲话一、肯定成绩再出发,始终保持政治定力近年来,我们高度重视作风
【其他范文】 日期:2021-01-27
-
县团委主题团日活动的实施方案_共青团主题团日活动
为充分调动广大团员发挥先锋模范作用的积极性和自觉性,永葆先进性,树立和维护党的良好形象,进一步加强和改进青少年思想道德建设,教育、引导、激励广大共青团员把先进性教...
【口号大全】 日期:2019-08-16
-
部队训练决心书:消防部队训练决心书
尊敬的各位领导,各位同志:我很荣幸接到上级领导布置下的军训任务。作为军人,服从命令是我们的天职。虽然这次军训任务中,训练量大,时间有限,但我们军人,一向不怕任务艰...
【口号大全】 日期:2019-07-28
-
公安局交警中队仓库保管员个人工作总结
转眼之间,一年的光阴又将匆匆逝去。回眸过去的一年,在公安局交警中队保管员工作岗位上,我始终秉承着“在
【毕业论文】 日期:2020-08-26
-
喜迎二十大,永远跟党走,奋进新征程征文免费(范文推荐)
征文是一个汉语词语,拼音是zhēngwén,指某个组织、机构、团体为了某个活动公开向社会征集有关的文章,有稿酬或无稿酬。该类文章可能有题目、题材、格式的限定,与作文大体...
【其他范文】 日期:2023-01-02
-
书记年度基层党建工作专项述职报告(全文完整)
书记2021年度基层党建工作专项述职报告今年以来,我认真履行党建工作第一责任人职责,坚持抓班子带队伍,抓实基层党建工作,全面夯实党的执政基础。现述职如下:一、履行基层党...
【其他范文】 日期:2022-08-22
-
理论中心组学习总体国家安全观发言材料9篇
理论中心组学习总体国家安全观发言材料9篇理论中心组学习总体国家安全观发言材料篇1(八)深入学习贯彻中央以及省的重要会议和文件精神深入学习贯彻年度内中央以
【发言稿】 日期:2022-08-04
-
军转座谈会交流发言4篇
军转座谈会交流发言4篇军转座谈会交流发言篇1大家好,我叫贺丽,2015届选调生,来自康定市委组织部,现在省委编办跟班学习。今天,非常荣幸向大家汇报我的学习收
【发言稿】 日期:2022-10-27
-
12岁生日小寿星发言4篇
12岁生日小寿星发言4篇12岁生日小寿星发言篇1各位来宾、各位朋友:大家好!今天,我们欢聚在这里,共同庆祝**十二周岁生日。首先,我代表**的父母以
【发言稿】 日期:2022-07-31
-
党内警告处分表态发言14篇
党内警告处分表态发言14篇党内警告处分表态发言篇1尊敬的各位领导、同事们:大家上午好!刚才会上宣布了党委关于我任职的决定,我首先衷心感谢党委的信任和
【发言稿】 日期:2022-09-13
-
【企业疫情风险控制方案】 2020企业复工疫情方案
企业疫情风险控制方案2020新冠病毒肺炎疫情防控工作总结汇报3篇 关于新型冠状病毒感染的肺炎疫
【演讲稿】 日期:2020-02-27
-
党内警告处分党员讨论发言3篇
党内警告处分党员讨论发言3篇党内警告处分党员讨论发言篇1大家好!作为新时期的一名大学生,认真学习、深刻领会、全面贯彻省党代会精神,是当前和今后一个时期重
【发言稿】 日期:2022-08-07
-
廉政大会总结发言稿7篇
廉政大会总结发言稿7篇廉政大会总结发言稿篇1各位领导,同志们:根据会议安排,我就党风廉政建设工作做表态发言,不妥之处,请批评指正。一、提高认识,切实
【发言稿】 日期:2022-10-30
-
被约谈的表态发言8篇
被约谈的表态发言8篇被约谈的表态发言篇1各位领导、各位党员大家好:这天我能站在鲜红的党旗下,
【发言稿】 日期:2022-12-24
-
破冰提能大讨论个人发言4篇
破冰提能大讨论个人发言4篇破冰提能大讨论个人发言篇1党史学习教育开展以来,我坚持读原著、学原文、悟原理。今天,根据会议安排,现在我就“学史明理”主题谈几点个
【发言稿】 日期:2022-10-09
-
巡察整改专题民主生活会总结发言8篇
巡察整改专题民主生活会总结发言8篇巡察整改专题民主生活会总结发言篇1按照区委统一部署和纪监委、巡察办关于召开党史学习教育专题组织生活会的工作安排,近期我紧贴
【发言稿】 日期:2022-10-12
-
2023年中国行政区划调整方案(设想优秀3篇
中国行政区划调整方案(设想优秀民政部第二次行政区划研讨会会议内容一、缩省的意义与原则1.意义1)利于减少中间层次中国行政区划层级之多为世界之最,既使管理成本
【周公解梦】 日期:2024-02-20
-
学习周永开先进事迹心得体会3篇
学习周永开先进事迹心得体会【一】通过学习周永开老先生先进事迹后,结合自己工作思考,感慨万千。同样作为
【格言】 日期:2021-04-10
-
2023年和儿媳妇在一起幸福的句子3篇
和儿媳妇在一起幸福的句子1、假如人生不曾相遇,我还是那个我,偶尔做做梦,然后,开始日复一日的奔波,淹没在这喧嚣的城市里。我不会了解,这个世界还有这样的一个你
【格言】 日期:2023-11-10
-
最满意的三项工作200字【最新党办公务员副主任提拔考察个人三年思想工作总结报告】
党办公务员个人三年工作总结近三年来,本人在组织、领导的关心指导和同事们的团结协作下,尽快完成主角的转
【格言】 日期:2021-02-26
-
XX老干局推进党建与业务深度融合发展工作情况调研报告:党建调研报告
XX老干局推进党建与业务深度融合 发展工作情况的调研报告 党建工作与业务工作融合发展始终是一个充满生
【成语大全】 日期:2020-08-28
-
中国共产党第三代中央领导集体的卓越贡献
中国共产党第三代中央领导集体的卓越贡献 --------------继往开来铸就辉煌 【摘要】改
【成语大全】 日期:2020-03-20
-
信息技术2.0能力点 [全国中小学教师信息技术应用能力提升工程试题题库及参考答案「精编」]
全国中小学教师信息技术应用能力提升工程试题题库及答案(复习资料)一、判断题题库(A为正确,B为错误)
【格言】 日期:2020-11-17
-
党建工作运行机制内容有哪些_构建基层党建工作运行机制探讨
党的基层组织是党在社会基层组织中的战斗堡垒,是党的全部工作和战斗力的基础。加强和改进县级以下各类党的
【经典阅读】 日期:2020-01-22
-
电大现代教育原理_最新国家开放大学电大《现代教育原理》形考任务2试题及答案
最新国家开放大学电大《现代教育原理》形考任务2试题及答案形考任务二一、多项选择题(共17道试题,共3
【成语大全】 日期:2020-07-20
-
集合推理_七,推理与集合
七推理与集合1 期中考试数学成绩出来了,三个好朋友分别考了88分,92分,95分。他们分别考了多少分
【名人名言】 日期:2020-12-18
-
关于三农工作重要论述心得体会3篇
关于三农工作重要论述心得体会3篇关于三农工作重要论述心得体会篇1习近平总书记指出:“建设现代化国家离不开农业农村现代化,要继续巩固脱贫攻坚成果,扎实推进乡村
【学习心得体会】 日期:2022-10-29
-
【福生庄隧道坍塌处理方案】 福生庄隧道在哪里
(呼和浩特铁路局大包电气化改造工程指挥部,内蒙古呼和浩特010050)摘要:文章介绍了福生庄隧道
【学习心得体会】 日期:2020-03-05
-
五个一百工程阅读心得体会13篇
五个一百工程阅读心得体会13篇五个一百工程阅读心得体会篇1凡益之道,与时偕行。在全国网络安全和信
【学习心得体会】 日期:2022-12-07
-
城管系统警示教育心得体会9篇
城管系统警示教育心得体会9篇城管系统警示教育心得体会篇1各党支部要召开多种形式的庆七一座谈会,组织广大党员进行座谈,回顾党的光辉历程,畅谈党的丰功伟绩,
【学习心得体会】 日期:2022-10-09
-
发展对象培训主要内容10篇
发展对象培训主要内容10篇发展对象培训主要内容篇1怀着无比激动的心情,我有幸参加了__新区区委党校20__年第四期(区级机关)党员发展对象培训班。这次的学习
【培训心得体会】 日期:2022-09-24
-
扶眉战役纪念馆心得体会11篇
扶眉战役纪念馆心得体会11篇扶眉战役纪念馆心得体会篇1有那么一段历史,低诉着血和泪的故事,慢慢地,随岁月老去;有那么一群人,放弃了闲逸的人生,辗转奔波中
【学习心得体会】 日期:2022-08-03
-
2022年全国检察长会议心得7篇
2022年全国检察长会议心得7篇2022年全国检察长会议心得篇1眼睛是心灵上的窗户,我们通过眼睛才能看到世间万物,才能看到眼前这美好的一切。拥有一双明亮的眼
【学习心得体会】 日期:2022-10-31
-
凝聚三种力量发展全过程人民民主心得体会12篇
凝聚三种力量发展全过程人民民主心得体会12篇凝聚三种力量发展全过程人民民主心得体会篇1新民主主义革命是指在帝国主义和无产阶级革命时代,殖民地半殖民地国家中的
【学习心得体会】 日期:2022-08-31
-
全面从严治党的心得体会800字7篇
全面从严治党的心得体会800字7篇全面从严治党的心得体会800字篇1中国特色社会主义是我们党领导
【学习心得体会】 日期:2022-12-14
-
教师全国两会精神学习专题研讨交流材料6篇
教师全国两会精神学习专题研讨交流材料6篇教师全国两会精神学习专题研讨交流材料篇1通过对两会精神深入系统的学习,作为新一代的青年人,更应该严格要求自己,贯彻落
【教师心得体会】 日期:2022-08-11
-
 2024年主题教育民主生活会批评与自我批评意见(38条)(范文推荐)
2024年主题教育民主生活会批评与自我批评意见(38条)(范文推荐)
2023年主题教育民主生活会六个方面个人检视、相互批评意见:1 理论学习系统性不强。学习习近平新时代中国特色社会主义思想不深不透,泛泛而学的时候多,深学细照的时候少,特...
【邓小平理论】 日期:2024-03-19
-
 2024年交流发言:强化思想理论武装,增强奋进力量(完整)
2024年交流发言:强化思想理论武装,增强奋进力量(完整)
习近平总书记指出:“一个民族要走在时代前列,就一刻不能没有理论思维,一刻不能没有思想指引。”党的十八大以来,伴随着新时代中国特色社会主义思想在实践中形成发展的历程...
【三个代表】 日期:2024-03-19
-
 2024年度镇年度县乡人大代表述职评议活动总结
2024年度镇年度县乡人大代表述职评议活动总结
xx镇20xx年县乡人大代表述职评议活动总结为响应县级人大常委会关于开展县乡两级人大代表述职评议活动,进一步激发代表履职活力,加强代表与人民群众的联系,提高依法履职水平...
【马克思主义】 日期:2024-03-19
-
 “千万工程”经验学习体会(研讨材料)
“千万工程”经验学习体会(研讨材料)
“千万工程”是总书记在浙江工作时亲自谋划、亲自部署、亲自推动的一项重大决策,也是习近平新时代中国特色社会主义思想在之江大地的生动实践。20年来,“千万工程”先后经历...
【三个代表】 日期:2024-03-19
-
 2024年在市政协机关工作总结会议上讲话
2024年在市政协机关工作总结会议上讲话
同志们:刚才,XX同志对市政协机关20XX年工作进行了很好的总结,很精炼,很到位,可以感受到去年机关工作确实可圈可点。XX同志宣读了表彰决定,机关优秀人员代表、先进集体代...
【邓小平理论】 日期:2024-03-18
-
 在全区防汛防涝动员暨河长制工作推进会上讲话提纲【完整版】
在全区防汛防涝动员暨河长制工作推进会上讲话提纲【完整版】
区长,各位领导,同志们:汛期已经来临,我区城区防涝工作面临强大考验,形势不容乐观。年初,区城区防涝排渍指挥部已经召开专题调度会,修订完善应急预案,建立网格化管理机...
【马克思主义】 日期:2024-03-18
-
 2024年镇作风整治工作实施方案(完整文档)
2024年镇作风整治工作实施方案(完整文档)
XX镇作风整治工作实施方案为深入贯彻落实党的二十大精神及省市区委深化作风建设的最新要求,突出重点推进干部效能提升,坚持不懈推动作风整治工作纵深发展,根据《关于印发《2...
【毛泽东思想】 日期:2024-03-18
-
 2024市优化法治化营商环境规范涉企行政执法实施方案【优秀范文】
2024市优化法治化营商环境规范涉企行政执法实施方案【优秀范文】
xx市优化法治化营商环境规范涉企行政执法实施方案为持续优化法治化营商环境,激发市场主体活力和社会创造力,规范行政执法行为,创新行政执法方式,提升行政执法质效,着力解...
【毛泽东思想】 日期:2024-03-18
-
 2024年度关于开展新一轮思想状况摸底排查工作通知(完整)
2024年度关于开展新一轮思想状况摸底排查工作通知(完整)
关于开展新一轮思想状况摸底排查工作的通知为深入贯彻落实关于各地开展干部职工思想状况大摸底大排查情况上的批示要求和改革教育第二次调度会议精神,有针对性做好队伍教育管...
【三个代表】 日期:2024-03-18
-
 2024年公路养护中心主任典型事迹材料(完整文档)
2024年公路养护中心主任典型事迹材料(完整文档)
“中心的工作就是心中的事业”——公路养护中心主任典型事迹材料**,男,1976年6月出生,1993年参加工作,2000年4月调入**区交通运输局工作,大学本科学历,中共党员,现任**...
【马克思主义】 日期:2024-03-17
