松材线虫热激蛋白家族成员结构与功能分析
郝 昕,邓 振,陈 洁,刁 健,李 洋,王欣然,马 玲
(东北林业大学林学院,哈尔滨 150040)
松材线虫Bursaphelechusxylophilus引起的松树萎蔫病(又称松材线虫病)是世界森林生态系统中具有极大危险性和破坏性的森林病害。该病害对亚洲和欧洲的松林造成毁灭性破坏,对森林生态安全造成严重威胁。自 1982年在我国首次发现松材线虫至今,虽全力防治,但全国由于松材线虫引起的破坏仍造成了数十亿株松树的损失,造成的经济损失和生态价值损失更是高达千亿元[1,2]。截至2021年,松树萎蔫病已在全国19个省(自治区、直辖市)、742个县级行政区发生,占县级行政区总数的26.1%。累计发生面积180.92万hm2,同比上升62.40%,造成病死松树1407.92万株,并且表现出由点状分布向片状发展及向西和向北快速扩散的态势[3,4]。松材线虫对我国松林破坏巨大,严重影响我国的森林生态系统安全,阻碍了我国生态文明建设进程。
热激蛋白(Heat Shock Proteins,HSPs)是一类广泛存在于细菌、真菌和动植物中的蛋白质分子家族。当生物体暴露于高温时,就会通过热激发合成此种蛋白,以保护有机体自身。按照蛋白的质量大小,热激蛋白共分为五个亚族,分别为HSP110、HSP90、HSP70、HSP60 以及小分子热激蛋白(small Heat Shock Proteins,sHSPs)[5]。许多热激蛋白具有分子伴侣活性,可以协助细胞内分子组装和蛋白质折叠发挥功能[6]。在秀丽线虫Caenorhabditiselegans中的研究表明热激蛋白不仅可以调节生物体对环境的适应能力,延长生物体的寿命,还会激活生物体提高对重金属及药物的抗性[7,8]。因此HSP基因是近年来对生物耐热机制等研究最多的蛋白之一[9]。对松材线虫Bx-HSPs基因家族成员的研究有助于了解松材线虫的扩散机制,进而为宏观把控和防治松材线虫的扩散和蔓延提供理论指导。
本研究基于NCBI数据库中的秀丽线虫HSPs基因和相关文献,利用BLAST(Basic Local Alignment Search Tool,https://blast.ncbi.nlm.nih.gov/Blast.cgi)比对松材线虫基因组数据,鉴定得到松材线虫中HSPs基因23个。利用生物信息学分析软件对获得的Bx-HSPs基因进行生物信息学特性分析,预测分析Bx-HSPs基因的具体功能。通过对Bx-HSPs基因特性及功能的具体分析,为研究松材线虫HSPs家族基因功能奠定基础,也为寻找潜在靶标基因,利用生物技术防治松材线虫病提供了理论支持。
1.1 Bx-HSPs基因家族成员进化关系及理化特性测定
为了解松材线虫Bx-HSPs家族成员信息,本研究从NCBI数据库(https://www.ncbi.nlm.nih.gov/)下载了秀丽线虫全部 HSPs基因。随后,以秀丽线虫 HSPs氨基酸序列作为检索序列在 Wormbase(https://wormbase.org)[10]上与松材线虫基因组[11]数据进行 BLAST比对,得到松材线虫 HSPs同源序列18个。加上文献已报道的5个松材线虫Bx-hsp基因Bx-hsp12(BXY_1656400.1)、Bx-hsp20(BXY_1035800.1)、Bx-hsp70(BXY_0013600.1)、Bx-hsp75(BXY_1666100.1)和Bx-hsp90(BXY_0009200.1),共23个HSPs基因[12,13]。
通过理化性质分析,可以为目标蛋白功能机制研究提供基础数据。在生物学中进化树用来表明物种之间的进化关系。通过进化树的构建,可以为预测目标蛋白的功能提供线索。应用蛋白分析(Expert Protein Analysis System,ExPASy)网站[14]中 ProtParam 工具(https://web.expasy.org/protparam/)[15]对Bx-HSPs蛋白的理化性质,如氨基酸数、相对分子量、理论等电点、脂肪系数、分子结构式、原子总数、不稳定系数等进行分析。通过Clustal X将得到的松材线虫Bx-HSPs基因进行序列比对分析[16],并通过CDD工具(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)对Bx-HSPs保守结构域进行预测[17],随后通过Mega 7软件中的邻位连接(neighbor-joining,NJ)法构建系统发育进化树,自展重复抽样检验1000次[18]。
1.2 蛋白质序列基序分析
通过MEME(https://meme-suite.org/meme/)方法对蛋白质序列的基序进行分析[19],随后通过Pfam数据库(http://pfam.xfam.org/)[20]和 InterPro数据库(http://www.ebi.ac.uk/interpro/)[21]获得基序注释信息。
1.3 疏水性和跨膜螺旋区域分析
蛋白质亲疏水性对蛋白的稳定性和功能具有重要的意义,而分析蛋白的跨膜结构域可以对目的蛋白属于何种功能蛋白做出研判,对预测蛋白的功能和作用有着重大意义。运用 ProtScale(https://web.expasy.org/protscale/)进行蛋白疏水性分析[22],运用TMHMM (http://www.cbs.dtu.dk/services/TMHMM)和PSORTb(http://www.psort.org/psortb/)预测蛋白质跨膜螺旋区(Transmem-Brane helical segments, TMHs)[23]。使用Protter网站(http://wlab.ethz.ch/protter/start/)对蛋白质的拓扑异构模型进行预测[24]。
1.4 磷酸化位点分析
蛋白质磷酸化是调节和控制蛋白质活力和功能的最基本、最普遍,也是最重要的机制。它与信号传导、细胞周期、生长发育等诸多生物学问题有着密不可分的关系,研究蛋白质磷酸化对阐明蛋白质功能具有重要的生物学意义。应用NetPhos 3.1 Serve(http://www.cbs.dtu.dk/services/NetPhos/)[25]预测蛋白质磷酸化位点。分析丝氨酸、苏氨酸、酪氨酸磷酸化位点数量。
1.5 蛋白质的二级结构预测及三级结构建模
通过对预测结构的分析,可以解释酶的催化机理或预测蛋白质的突变位点,从而推断蛋白质结构与功能的关系。研究蛋白质的空间结构,有利于了解蛋白质的执行功能,确定蛋白质的结构对于生物学研究是非常重要的。本研究通过SOPMA(https://npsaprabi.ibcp.fr/cgi-bin/secpred_sopma.pl)预测Bx-HSPs蛋白质的二级结构[26],运用 SWISS-MODEL(https://swissmodel.expasy.org/)对Bx-HSPs蛋白质的三级结构进行同源建模[27]。
2.1 Bx-HSPs基因家族的鉴定及理化性质分析
从松材线虫基因组中鉴定得到23个松材线虫Bx-HSPs基因家族成员(表1)。这23个松材线虫Bx-HSPs基因相对应的蛋白质氨基酸组成数量与相对分子质量具有显著性差异(表 2)。氨基酸组成数量为 111~770,平均氨基酸数量为373.91。相对分子质量为12631.16~88459.08,平均为42107.39。这些蛋白质的理论等电点为 4.67~8.89,脂肪系数为 47.01~97.92。由此可见,这些蛋白质的热稳定性发生了明显变化。蛋白质亲水性系数为-1.246~-0.101,蛋白质的亲水系数均为负值,表明上述23种热激蛋白均为疏水蛋白。这些蛋白质均由C、H、N、O和S五种原子组成。原子总数为1766~12464个不等。蛋白不稳定系数区间为26.22~62.90,共有12个蛋白质的不稳定系数大于40,其中有9个为小热激蛋白,表明小热激蛋白结构不稳定可能性更高,而其他11种蛋白质的系数小于40,其中有6个预测结果为HSP70,表明HSP70 的结构更稳定。

表1 Bx-HSPs家族成员与秀丽线虫HSPs家族成员对照表Table 1 Comparison table of Bx-HSPs and Ce-HSPs
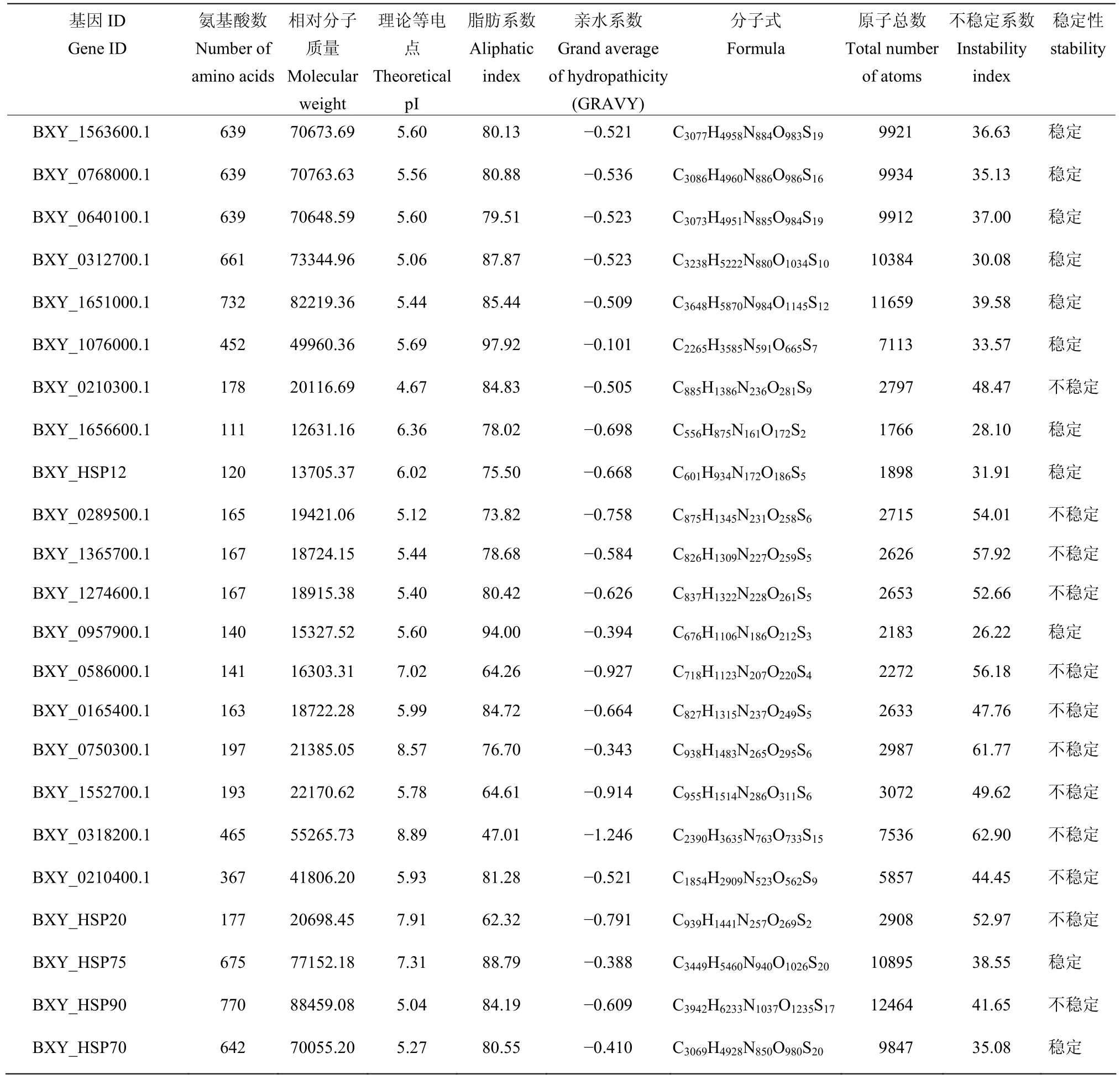
表2 Bx-HSPs家族成员蛋白质理化性质分析结果Table 2 Results of physicochemical properties of Bx-HSPs
2.2 系统发育进化树及蛋白质基序
通过构建 NJ系统发育进化树(图 1)初步揭示了松材线虫 HSPs家族成员的系统发育进化关系,以bootstrap多重采样检测作为结果的可靠性基础。由表3可知,与预期相同,Bx-HSPs 家族蛋白质,特别是那些具有相似进化关系的蛋白质,均含有相同或相似的蛋白质基序。通过MEME对序列的详细分析,得到了15个保守的蛋白质序列基序(图2)。随后,通过Pfam和InterProScan对蛋白质基序进行分析,结果表明,基序8和基序9为HSP20结构域,其他基序为HSP70结构域。

图1 Bx-HSPs家族成员系统进化发育树Fig.1 Phylogenetic tree of Bx-HSPs.
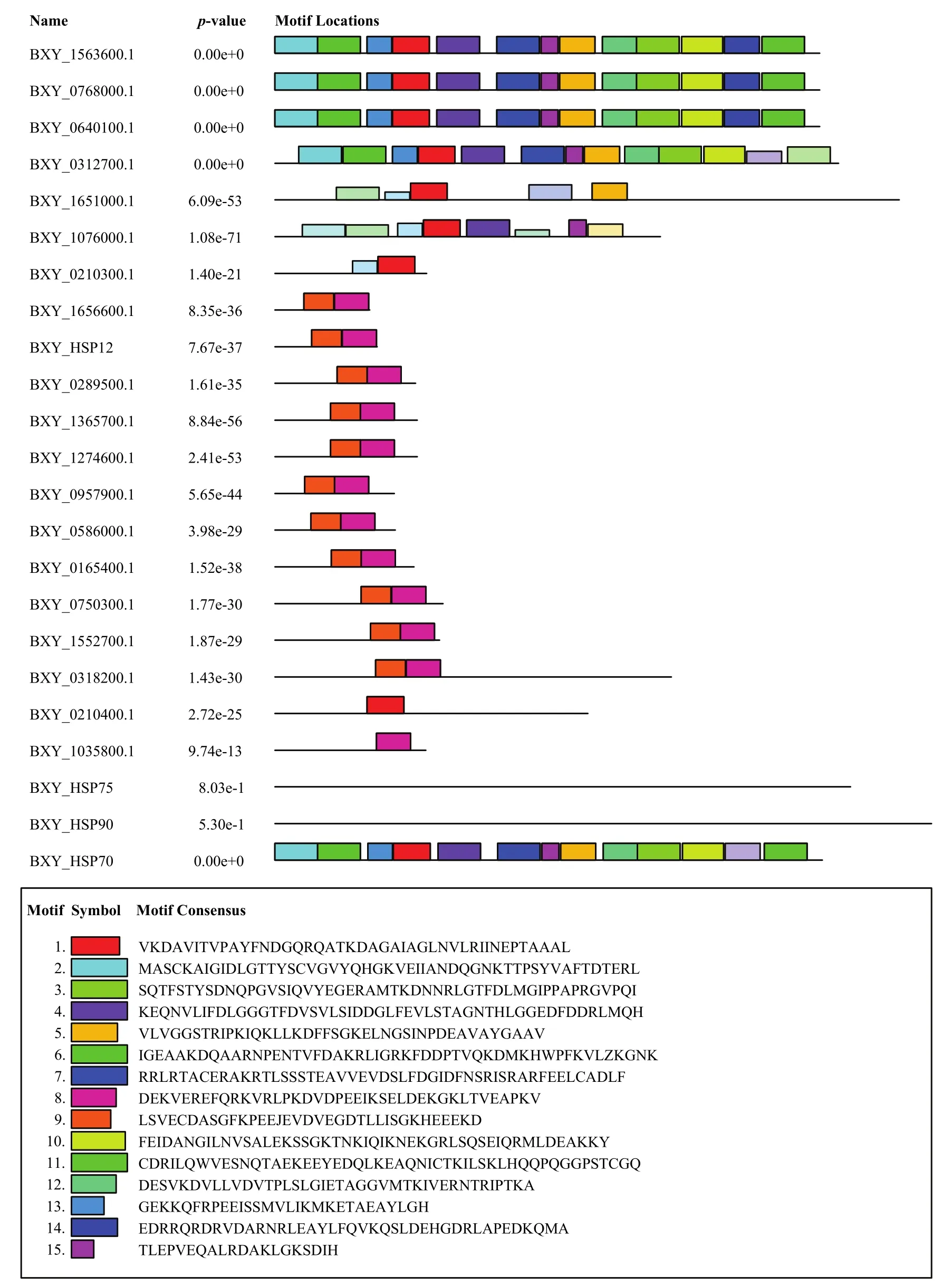
图2 Bx-HSPs家族成员蛋白质基序示意图Fig.2 The motifs analysis of Bx-HSPs

表3 Bx-HSPs家族成员蛋白质基序分析Table 3 The motifs analysis of Bx-HSPs.
根据 Pfam 和 InterProScan分析各蛋白质序列结构可知,BXY_0210400.1、BXY_1656600.1、BXY_HSP12、BXY_0289500.1、BXY_1365700.1、BXY_1274600.1、BXY_0957900.1、BXY_0586000.1、BXY_0165400.1、BXY_0750300.1、BXY_1552700.1和BXY_ HSP20为small HSP亚家族成员,而BXY_1563600.1、BXY_0768000.1、BXY_0640100.1、BXY_0312700.1、BXY_1651000.1、BXY_1076000.1、BXY_0218300.1、BXY_0318200.1、BXY_HSP70为HSP70亚家族成员。随后对没有通过MEME分析得到蛋白质基序的BXY_HSP75和BXY_HSP90进行Conserved Domains Search分析研究发现,这两个蛋白属于HSP90亚家族成员。
2.3 Bx-HSPs家族成员蛋白质疏水性和跨膜螺旋区分析
蛋白质疏水性分析结果以BXY_1563600.1为例对Bx-HSPs家族成员蛋白质疏水性分析结果进行说明。BXY_1563600.1蛋白中的第531位精氨酸(R)具有-3.944的低疏水性评分,由此可知它具有很高的亲水性。相反,第395位的天冬氨酸(D)具有2.022的较高疏水性得分,表明其更具有疏水性。表4中列出了该家族氨基酸序列的疏水性分析结果,由该结果可知,该家族中的蛋白质包含多个亲水性和疏水性区域,但是他们的分布和聚集现象并不显著。而通过TMHMM和PSORTb对蛋白质序列分析发现,该家族成员除BXY_1076000.1和 BXY_HSP90存在跨膜结构外,其余家族成员均属于胞内蛋白。

表4 Bx-HSPs家族成员蛋白质疏水性分析Table 4 Protein hydrophobicity analysis of Bx-HSPs
2.4 拓扑异构模型预测
蛋白质糖基化修饰除了影响蛋白质的空间构象、生物活性、运输和定位,还在分子识别、细胞通信、信号转导等生物过程中发挥着重要的作用,因此糖基化位点分析具有十分重要的意义。Bx-HSPs家族成员蛋白质拓扑结构分析结果表明(表5),该家族蛋白质结构上含有0~7个N-糖基化位点。其中BXY-HSP70具有最多的N-糖基化位点个数,共计有7个。研究表明,N-糖基化位点的存在对于蛋白质的折叠和运输非常重要。因此,该预测结果可以从另一个角度证实Bx-HSPs家族成员的分子伴侣特性。

表5 Bx-HSPs家族成员蛋白质拓扑结构分析Table 5 Protein topological structure analysis of Bx-HSPs
2.5 二级结构分析及三级结构建模
蛋白质的二级结构包含局部残基之间由氢键所调节的相互作用。最普遍的二级结构就是α-螺旋及β-折叠,此外还有β-转角和无规卷曲。Bx-HSPs家族成员二级结构分析结果表明(表6),Bx-HSPs家族成员α-螺旋占比为15.00%~58.61%,其中sHSPs的成员α-螺旋占比均小于40%;
Bx-HSPs家族成员β-折叠占比为10.93%~27.93%;
Bx-HSPs家族成员β-转角占比为2.46%~12.90%;
Bx-HSPs家族成员无规卷曲占比为27.21%~55.00%,其中sHSPs的成员无规卷曲占比均大于40%。三级结构建模结果表明(图3),Bx-HSP70亚家族、Bx-HSP90亚家族及Bx-sHSP亚家族三级结构有明显的形态学区别,因此执行着不同的生物学功能。

表6 Bx-HSPs家族成员中构成蛋白质二级结构的氨基酸数量分析Table 6 The number of amino acids that constitute the secondary structure in BX-HSPs.

图3 Bx-HSPs家族成员三级结构分析Fig.3 The results of tertiary structure by Swiss-MODEL.
松材线虫是世界多国公认的外来入侵生物,由其引起的松树萎蔫病导致松属和杉属等针叶树种植物大量萎蔫死亡,危害极其严重[28]。随着社会的进步和发展,人类活动对自然界的影响日益加剧,而如松材线虫等外来生物的入侵风险也日益受到广泛关注[29]。外来生物发挥自身潜能是在新环境下形成入侵和扩散的关键[12]。本研究从生物信息学水平上分析热激蛋白家族成员结构与功能,为今后进一步在分子水平上开展松材线虫对温度适应性的研究打下了基础。
本研究对松材线虫Bx-HSPs家族成员进行了多种形式的生物信息学分析。首先运用ProtParam工具对Bx-HSPs家族成员的理化性质进行分析,为目标蛋白功能机制研究提供基础数据。随后运用邻接法(NJ method)构建了Bx-HSPs家族成员的系统发育进化树,从而比较Bx-HSPs家族中各成员的序列相似性。由于亲疏水性在蛋白质结构和功能中起着至关重要的作用,因此本研究通过对蛋白质疏水性分析,分析了 Bx-HSPs家族成员的结构特点。N-糖基化位点的数量对蛋白质的折叠和运输起着重要作用,因此本研究对Bx-HSPs家族成员拓扑结构进行了分析,结果证明了Bx-HSPs家族成员的分子伴侣特性。
截至目前,尽管有研究指出松材线虫HSPs家族成员中有部分基因的变化使线虫表现出对温度改变的适应性,但还没有关于松材线虫HSPs家族成员系统化报道。本研究的结果分析了松材线虫HSPs家族成员调控线虫响应温度适应性的结构基础。而该家族基因调控松材线虫响应温度适应性的调控机制还有待后续研究进行进一步探索与发现。本研究的目的在于为探索松材线虫扩散的分子机制提供基础,从而为松材线虫的预测预报提供理论支持。
猜你喜欢 松材线虫蛋白 夏季蔬菜换茬期线虫防治要注意今日农业(2022年14期)2022-09-15RNA结合蛋白与恶性肿瘤发生发展关系的研究进展中国现代医生(2022年21期)2022-08-22叶尔羌河流域长身高原鳅寄生线虫的感染情况及分布类型淡水渔业(2022年1期)2022-02-23松材线虫病的危害与综合防治对策世界热带农业信息(2021年12期)2021-11-18小虫子带来的长寿启示大众健康(2021年7期)2021-07-28细砂糖对法式蛋白糖的质量影响研究广东教育·职教版(2021年3期)2021-04-20松材线虫病多种防治措施成效世界热带农业信息(2020年1期)2020-12-28宁波市松材线虫病疫情继续“双下降”浙江林业(2019年12期)2019-02-02水通道蛋白的发现学校教育研究(2018年27期)2018-05-14松材线虫病综合防治技术探讨南方农业·下旬(2016年5期)2016-05-14- 范文大全
- 说说大全
- 学习资料
- 语录
- 生肖
- 解梦
- 十二星座
-
主题党日活动交流发言8篇
主题党日活动交流发言8篇主题党日活动交流发言篇13月13日,东城区党史学习教育动员大会召开。市委
【活动总结】 日期:2022-12-23
-
2022年4月主题党日活动记录范文15篇
2022年4月主题党日活动记录范文15篇2022年4月主题党日活动记录范文篇1一个崇尚阅读的民族,必然精神饱满、意气风发、活力四射。习近平总书记强调:“学习
【活动总结】 日期:2022-08-01
-
家乡赋|最美的家乡赋
家乡赋 孙传志 今安康市,白河双丰镇,吾之家乡也。三环沃土,山水环抱。其北依山,山系五岭,山
【调研报告】 日期:2020-04-01
-
党支部1-12月全年主题党日活动计划表
2022年党支部主题党日活动计划表序号活动时间活动方式活动内容12022年1月专题学习研讨集中观看2022年新年贺词,积极开展学习研讨交流。组织生活会组织党员认真对照党章...
【活动总结】 日期:2022-10-14
-
【人教版1-6年级数学上册知识点精编】1-6年级数学人教版教材
人教版二年级数学上册知识点汇总第一单元长度单位一、米和厘米1、测量物体的长度时,要用统一的标准去测量
【调研报告】 日期:2020-11-08
-
2022年2月份主题党日活动记录5篇
2022年2月份主题党日活动记录5篇2022年2月份主题党日活动记录篇1尊敬的党组织:在今年的开学初,本人积极参加教研室组织的教研活动,在学校教研员的指
【活动总结】 日期:2022-08-12
-
少先队的光荣历史故事 队前教育-光辉历程
2017-2018学年队前教育1光辉历程一、劳动童子团1924——1927二、三十年代年的中国是一个
【法律文书】 日期:2020-06-23
-
医院最佳主题党日活动11篇
医院最佳主题党日活动11篇医院最佳主题党日活动篇1 医院最佳主题党日活动篇2为隆重纪念中国共产党成立100周年,进一步巩固党的群众路线教育实践活动成果,切实
【活动总结】 日期:2022-10-29
-
2023年平安校园建设方案13篇
平安校园建设方案“平安校园”创建工作,我们幼儿园全体教职员工一直把它当作头等大事来抓。领导高度重视,以“平安校园”创建活动为抓手,建立和规范校园安全工作机制
【规章制度】 日期:2023-11-02
-
主题党日活动记录202210篇
主题党日活动记录202210篇主题党日活动记录2022篇12021年是中国共产党成立100周年,为广泛开展爱国主义宣传教育,铭记党的历史,讴歌党的光辉历程,
【活动总结】 日期:2022-08-02
-
正式的晚宴邀请函 公司晚宴邀请函
尊敬的先生 女士: 我公司谨定于xxxx年xx月xx日xx:xx在xxxx店隆重举行xx市xx届xxxx晚宴(宴会地址:xx区xx路xxxx) 敬请届时光临!xxxxxx集团股份有限公司xxxx有限公司敬邀xxxx年xx月xx日
【简历资料】 日期:2019-08-03
-
《国行公祭,为佑世界和平》课文原文阅读_国行公祭为佑世界和平每段段意
国行公祭,为佑世界和平钟声“国行公祭,法立典章。铸兹宝鼎,祀我国殇。”侵华日军南京大屠杀遇难同胞纪念
【简历资料】 日期:2020-11-28
-
一年级新学期目标简短_一年级学生新学期打算
新学期到了,我是一年级下册的小学生了。 上课的时候,我要认真学习,不做小动作,认真听讲。我要认真学习,天天向上,努力学习,耳朵要听老师讲课,眼睛要瞪得大大的看老...
【简历资料】 日期:2019-10-26
-
[信访复查复核制度作用探讨]信访复查复核有用吗
作为我国特有的一项制度,信访制度的出现并长期存在不是偶然的,虽然一些法学专家认为信访制度具有“人治”
【职场指南】 日期:2020-02-16
-
[党员干部2019年主题教育个人问题检视清单及整改措施2篇] 党员干部
2019年主题教育问题检视清单及整改措施根据主题教育领导小组办公室《关于认真做好主题教育检视问题整改
【求职简历】 日期:2019-11-08
-
网络维护工作内容_(精华)国家开放大学电大专科《网络系统管理与维护》形考任务1答案
国家开放大学电大专科《网络系统管理与维护》形考任务1答案形考任务1理解上网行为管理软件的功能【实训目
【职场指南】 日期:2020-07-17
-
党委会与局长办公会的区别_局长办公会制度
为进一步加强xxx局工作的规范化、制度化建设,提高行政效能,规范议事程序,特制定本制度。一、会议形式1、局长办公会议由局长、副局长参加。由局长召集和主持。根据工作需要...
【求职简历】 日期:2019-07-30
-
《铁拳砸碎“黑警伞”》警示教育片观后感
影片深刻剖析了广西北海市公安局海西派出所原所长张枭杰蜕变堕落的轨迹。观看警示教育片后,做为一名党员教
【简历资料】 日期:2020-08-17
-
如何凝心聚力谋发展【坚定信心谋发展凝心聚力促跨越】
当前,清河正处于在苏北实现赶超跨越基础上全面腾飞的战略机遇期,处于在全市率先实现全面小康基础上率先实
【简历资料】 日期:2020-03-17
-
学生会组织部部长竞选稿5篇
学生会组织部部长竞选稿以“三制”为统领推进农村党的建设中共**市委组织部近年来,**市认真落实中央、省和徐州市委的部署,积极适应发展要求,从加强领导体制、运
【求职简历】 日期:2023-11-06
-
X街道年度工作总结
今年正值中国百年华诞和“十四五”规划开局之年历史交汇的关键节点,我街道在区党委、管委的坚强领导下,以***新时代中国特色社会主义思想为指导,坚持党建引领,积极开展党史...
【其他范文】 日期:2022-10-18
-
学习“四史”心得体会_生在新中国、长在红旗下|
学习“四史”心得体会 2020年随着“四史”教育的进一步推进,这一脉相传的学习过程,让我深刻的领会
【其他范文】 日期:2020-10-06
-
[乡镇2021半年总结及工作计划]
乡镇2021半年总结及工作计划一、上半年主要工作总结。在区委、区zf和镇党w坚强领导下,全镇人民坚持
【节日庆典】 日期:2021-07-13
-
[xx年交通局工作总结(一)]
xx年交通局工作总结(一)撰写人:___________日期:___________xx年交通局工作
【评语寄语】 日期:2021-02-18
-
临床路径引导下的康复护理用于急性心肌梗死PCI术后患者的效果
于志华(许昌市中心医院,河南许昌461000)急性心肌梗死临床常见,其致残率、致死率较高。PCI是治
【其他范文】 日期:2023-02-25
-
A,公司合并报表分析——基于资金管控视角
王泽平企业资金管控模式一般分为三种,一是集权式资金管控;二是分权式资金管控;三是建立独立的财务共享中
【其他范文】 日期:2023-01-12
-
[大学生社区实践报告] 社区服务实践报告3000
一,社区的概况1 物业情况该小区于9月竣工,开发商与三环物业管理有限责任公司签定前期物业管理合同。该小区为住宅小区,总建筑面积30万平方米,容积率为1 54,绿化覆盖率为...
【节日庆典】 日期:2019-07-23
-
【寝室喝酒检讨书】 寝室喝酒检讨书3000字
导读:检讨书范文,寝室喝酒检讨书怎么写,格式要求,写法技巧,科教范文网展示的这篇文章是很好的参考:12月24日晚,因为在寝室内被发现藏有啤酒所以写了这份检讨书,在这里...
【评语寄语】 日期:2019-09-21
-
轮胎购销合同范本3篇|
轮胎购销合同范本3篇 轮胎购销合同范文1 甲方: 乙方: 甲乙双方经协商《从事轮胎购销业务,
【毕业论文】 日期:2021-03-12
-
2022年机关预备党员第三季度思想汇报(精选文档)
思想报告,也叫思想汇报,是党员或申请入党的积极分子与党组织保持经常联系、沟通,求得帮助指导的一种方式,有书面和口头两种形式。自递交入党申请书开始每三个月写一次思想...
【其他范文】 日期:2023-01-06
-
军转座谈会交流发言4篇
军转座谈会交流发言4篇军转座谈会交流发言篇1大家好,我叫贺丽,2015届选调生,来自康定市委组织部,现在省委编办跟班学习。今天,非常荣幸向大家汇报我的学习收
【发言稿】 日期:2022-10-27
-
12岁生日小寿星发言4篇
12岁生日小寿星发言4篇12岁生日小寿星发言篇1各位来宾、各位朋友:大家好!今天,我们欢聚在这里,共同庆祝**十二周岁生日。首先,我代表**的父母以
【发言稿】 日期:2022-07-31
-
廉政大会总结发言稿7篇
廉政大会总结发言稿7篇廉政大会总结发言稿篇1各位领导,同志们:根据会议安排,我就党风廉政建设工作做表态发言,不妥之处,请批评指正。一、提高认识,切实
【发言稿】 日期:2022-10-30
-
被约谈的表态发言8篇
被约谈的表态发言8篇被约谈的表态发言篇1各位领导、各位党员大家好:这天我能站在鲜红的党旗下,
【发言稿】 日期:2022-12-24
-
破冰提能大讨论个人发言4篇
破冰提能大讨论个人发言4篇破冰提能大讨论个人发言篇1党史学习教育开展以来,我坚持读原著、学原文、悟原理。今天,根据会议安排,现在我就“学史明理”主题谈几点个
【发言稿】 日期:2022-10-09
-
纪委书记工作表态发言4篇
纪委书记工作表态发言4篇纪委书记工作表态发言篇1在镇党委政府正确领导下,在全村干部和群众的共同努力下,紧紧围绕建设社会主义新农村工作为重点,尽职尽责,与时俱
【发言稿】 日期:2022-09-30
-
我最敬佩的人开头_我敬佩的一个人作文20篇2020年
我敬佩的一个人作文20篇 我敬佩的一个人作文一): 我身边有很多值得我们敬佩的人,但我最敬佩的一
【发言稿】 日期:2020-11-10
-
党员教育培训总结交流发言12篇
党员教育培训总结交流发言12篇党员教育培训总结交流发言篇1根据市委组织部《关于开展我市〈20XX
【发言稿】 日期:2022-12-19
-
[钻井队队长(副队长、指导员)岗位HSE应知应会试题(1863)]
钻井队队长(副队长、指导员)岗位HSE应知应会试题(判断题:771;单选题:626;多选题:466)
【贺词】 日期:2020-09-23
-
话剧《家》剧本 话剧剧本:爱的空间
找文章到更多原创-(http: www damishu cn)人物介绍:刘伟,男,32岁,某购物广
【演讲稿】 日期:2020-01-21
-
学习周永开先进事迹心得体会3篇
学习周永开先进事迹心得体会【一】通过学习周永开老先生先进事迹后,结合自己工作思考,感慨万千。同样作为
【格言】 日期:2021-04-10
-
XX老干局推进党建与业务深度融合发展工作情况调研报告:党建调研报告
XX老干局推进党建与业务深度融合 发展工作情况的调研报告 党建工作与业务工作融合发展始终是一个充满生
【成语大全】 日期:2020-08-28
-
中国共产党第三代中央领导集体的卓越贡献
中国共产党第三代中央领导集体的卓越贡献 --------------继往开来铸就辉煌 【摘要】改
【成语大全】 日期:2020-03-20
-
信息技术2.0能力点 [全国中小学教师信息技术应用能力提升工程试题题库及参考答案「精编」]
全国中小学教师信息技术应用能力提升工程试题题库及答案(复习资料)一、判断题题库(A为正确,B为错误)
【格言】 日期:2020-11-17
-
党建工作运行机制内容有哪些_构建基层党建工作运行机制探讨
党的基层组织是党在社会基层组织中的战斗堡垒,是党的全部工作和战斗力的基础。加强和改进县级以下各类党的
【经典阅读】 日期:2020-01-22
-
集合推理_七,推理与集合
七推理与集合1 期中考试数学成绩出来了,三个好朋友分别考了88分,92分,95分。他们分别考了多少分
【名人名言】 日期:2020-12-18
-
电大现代教育原理_最新国家开放大学电大《现代教育原理》形考任务2试题及答案
最新国家开放大学电大《现代教育原理》形考任务2试题及答案形考任务二一、多项选择题(共17道试题,共3
【成语大全】 日期:2020-07-20
-
2023年中国行政区划调整方案(设想优秀3篇
中国行政区划调整方案(设想优秀民政部第二次行政区划研讨会会议内容一、缩省的意义与原则1.意义1)利于减少中间层次中国行政区划层级之多为世界之最,既使管理成本
【周公解梦】 日期:2024-02-20
-
基层党务工作基本内容_党建基本工作有哪些
党建基本工作有哪些(一) 基层党建工作包括哪些内容 选择了大学生村官这条路,你就与农村基层党
【名人名言】 日期:2020-08-06
-
[人生赠言]城隍庙人生赠言注释
人之相惜惜于品,人之相敬敬于德,人之相交交于情,人之相随随于义,人之相拥拥于礼,人之相信信于诚,人之相伴伴于爱! 人生的确很累,看你如何品味,每天多寻欢乐,烦...
【格言】 日期:2019-07-14
-
关于三农工作重要论述心得体会3篇
关于三农工作重要论述心得体会3篇关于三农工作重要论述心得体会篇1习近平总书记指出:“建设现代化国家离不开农业农村现代化,要继续巩固脱贫攻坚成果,扎实推进乡村
【学习心得体会】 日期:2022-10-29
-
【福生庄隧道坍塌处理方案】 福生庄隧道在哪里
(呼和浩特铁路局大包电气化改造工程指挥部,内蒙古呼和浩特010050)摘要:文章介绍了福生庄隧道
【学习心得体会】 日期:2020-03-05
-
五个一百工程阅读心得体会13篇
五个一百工程阅读心得体会13篇五个一百工程阅读心得体会篇1凡益之道,与时偕行。在全国网络安全和信
【学习心得体会】 日期:2022-12-07
-
城管系统警示教育心得体会9篇
城管系统警示教育心得体会9篇城管系统警示教育心得体会篇1各党支部要召开多种形式的庆七一座谈会,组织广大党员进行座谈,回顾党的光辉历程,畅谈党的丰功伟绩,
【学习心得体会】 日期:2022-10-09
-
发展对象培训主要内容10篇
发展对象培训主要内容10篇发展对象培训主要内容篇1怀着无比激动的心情,我有幸参加了__新区区委党校20__年第四期(区级机关)党员发展对象培训班。这次的学习
【培训心得体会】 日期:2022-09-24
-
扶眉战役纪念馆心得体会11篇
扶眉战役纪念馆心得体会11篇扶眉战役纪念馆心得体会篇1有那么一段历史,低诉着血和泪的故事,慢慢地,随岁月老去;有那么一群人,放弃了闲逸的人生,辗转奔波中
【学习心得体会】 日期:2022-08-03
-
凝聚三种力量发展全过程人民民主心得体会12篇
凝聚三种力量发展全过程人民民主心得体会12篇凝聚三种力量发展全过程人民民主心得体会篇1新民主主义革命是指在帝国主义和无产阶级革命时代,殖民地半殖民地国家中的
【学习心得体会】 日期:2022-08-31
-
2022年全国检察长会议心得7篇
2022年全国检察长会议心得7篇2022年全国检察长会议心得篇1眼睛是心灵上的窗户,我们通过眼睛才能看到世间万物,才能看到眼前这美好的一切。拥有一双明亮的眼
【学习心得体会】 日期:2022-10-31
-
全面从严治党的心得体会800字7篇
全面从严治党的心得体会800字7篇全面从严治党的心得体会800字篇1中国特色社会主义是我们党领导
【学习心得体会】 日期:2022-12-14
-
矫正心得体会6篇
矫正心得体会6篇矫正心得体会篇1今天,是自己出监后第一次参加阳光中途之家组织的社区矫正方面的教育
【学习心得体会】 日期:2022-12-24
-
 2024年主题教育民主生活会批评与自我批评意见(38条)(范文推荐)
2024年主题教育民主生活会批评与自我批评意见(38条)(范文推荐)
2023年主题教育民主生活会六个方面个人检视、相互批评意见:1 理论学习系统性不强。学习习近平新时代中国特色社会主义思想不深不透,泛泛而学的时候多,深学细照的时候少,特...
【邓小平理论】 日期:2024-03-19
-
 2024年交流发言:强化思想理论武装,增强奋进力量(完整)
2024年交流发言:强化思想理论武装,增强奋进力量(完整)
习近平总书记指出:“一个民族要走在时代前列,就一刻不能没有理论思维,一刻不能没有思想指引。”党的十八大以来,伴随着新时代中国特色社会主义思想在实践中形成发展的历程...
【三个代表】 日期:2024-03-19
-
 2024年度镇年度县乡人大代表述职评议活动总结
2024年度镇年度县乡人大代表述职评议活动总结
xx镇20xx年县乡人大代表述职评议活动总结为响应县级人大常委会关于开展县乡两级人大代表述职评议活动,进一步激发代表履职活力,加强代表与人民群众的联系,提高依法履职水平...
【马克思主义】 日期:2024-03-19
-
 “千万工程”经验学习体会(研讨材料)
“千万工程”经验学习体会(研讨材料)
“千万工程”是总书记在浙江工作时亲自谋划、亲自部署、亲自推动的一项重大决策,也是习近平新时代中国特色社会主义思想在之江大地的生动实践。20年来,“千万工程”先后经历...
【三个代表】 日期:2024-03-19
-
 2024年在市政协机关工作总结会议上讲话
2024年在市政协机关工作总结会议上讲话
同志们:刚才,XX同志对市政协机关20XX年工作进行了很好的总结,很精炼,很到位,可以感受到去年机关工作确实可圈可点。XX同志宣读了表彰决定,机关优秀人员代表、先进集体代...
【邓小平理论】 日期:2024-03-18
-
 在全区防汛防涝动员暨河长制工作推进会上讲话提纲【完整版】
在全区防汛防涝动员暨河长制工作推进会上讲话提纲【完整版】
区长,各位领导,同志们:汛期已经来临,我区城区防涝工作面临强大考验,形势不容乐观。年初,区城区防涝排渍指挥部已经召开专题调度会,修订完善应急预案,建立网格化管理机...
【马克思主义】 日期:2024-03-18
-
 2024年镇作风整治工作实施方案(完整文档)
2024年镇作风整治工作实施方案(完整文档)
XX镇作风整治工作实施方案为深入贯彻落实党的二十大精神及省市区委深化作风建设的最新要求,突出重点推进干部效能提升,坚持不懈推动作风整治工作纵深发展,根据《关于印发《2...
【毛泽东思想】 日期:2024-03-18
-
 2024市优化法治化营商环境规范涉企行政执法实施方案【优秀范文】
2024市优化法治化营商环境规范涉企行政执法实施方案【优秀范文】
xx市优化法治化营商环境规范涉企行政执法实施方案为持续优化法治化营商环境,激发市场主体活力和社会创造力,规范行政执法行为,创新行政执法方式,提升行政执法质效,着力解...
【毛泽东思想】 日期:2024-03-18
-
 2024年度关于开展新一轮思想状况摸底排查工作通知(完整)
2024年度关于开展新一轮思想状况摸底排查工作通知(完整)
关于开展新一轮思想状况摸底排查工作的通知为深入贯彻落实关于各地开展干部职工思想状况大摸底大排查情况上的批示要求和改革教育第二次调度会议精神,有针对性做好队伍教育管...
【三个代表】 日期:2024-03-18
-
 2024年公路养护中心主任典型事迹材料(完整文档)
2024年公路养护中心主任典型事迹材料(完整文档)
“中心的工作就是心中的事业”——公路养护中心主任典型事迹材料**,男,1976年6月出生,1993年参加工作,2000年4月调入**区交通运输局工作,大学本科学历,中共党员,现任**...
【马克思主义】 日期:2024-03-17
