西方蜜蜂工蜂蛹中期响应低温胁迫的差异表达基因分析
李 寒, 徐新建,2, 周姝婧,2, 周冰峰,2, 朱晨煜, 许宏智, 姚 丹,刘一名, 王 青, 李 想, 王茗琦, 朱翔杰,2,*
(1. 福建农林大学动物科学学院(蜂学学院), 福州 350002; 2. 福建农林大学蜜蜂研究所, 福州 350002;3. 广西中医药大学, 广西高发传染病中西医结合转化医学重点实验室, 南宁 530000; 4. 泉州师范学院, 福建泉州 362000)
温度作为最重要的生态因子之一,对蜜蜂的生长发育、蜂群活动、蜜蜂个体行为、抗病抗逆力均有影响(Irwinetal., 2000; Stabentheineretal., 2021)。蜜蜂个体发育对温度敏感,与多数昆虫相比,更易受温度影响。蜜蜂属于全变态昆虫,其卵、虫、蛹统称为蜂子。蜂子的发育温区非常狭窄,蜜蜂卵的发育温区为31~38℃,封盖子的发育温区为29~38℃,最适发育温度为35℃ (朱翔杰等, 2006; Medrzyckietal., 2010; 周冰峰等, 2011)。蜜蜂卵期低温会导致发育历期延长、死亡率升高(陈琳等, 2016)。蜜蜂封盖子是老熟幼虫和蛹的总称,发育历期12 d,该期低温处理会出现封盖子死亡率升高、羽化蜜蜂寿命缩短和封盖幼虫倒置等现象(Wangetal., 2016),翅脉形态异常(Zhuetal., 2018),采集与学习记忆能力受到影响(Tautzetal., 2003; Jonesetal., 2005),且低温使与记忆相关基因谷氨酸受体A型基因(Glu-RA)及N-甲基-D-天冬氨酸受体I型基因(NmdarI)显著下调表达(Yuanetal., 2016)。
前期有人关注了意大利蜜蜂Apismelliferaligustica和中华蜜蜂Apisceranacerana越冬不同时期工蜂可能具有的与抗寒基因表达量有关的低温抵御机制(Xuetal., 2017; Qinetal., 2019),处于化蛹发育时期的蜂子进行低温胁迫的差异表达基因(differentially expressed genes, DEGs)主要与发育相关激素调控有关(姚丹等, 2020),并未发现与越冬工蜂相同的抗寒相关的DEGs,说明发育阶段的蜜蜂与蜜蜂成虫对低温的响应差异较大,蜜蜂发育阶段忍受低温的机制还未知。研究发现处于蛹中期的8 d封盖子(复眼颜色呈深棕色, 关节处轻微着色)在受到96 h长时间低温胁迫后,恢复正常发育温度,并未出现封盖子死亡现象,该时期成为研究蜜蜂发育阶段如何忍受低温一个很好的时间窗口。同时研究发现这些经受住低温的蜜蜂羽化后,寿命却缩短50%(Wangetal., 2016),说明低温胁迫对其发育仍有不利影响。因此,本研究对西方蜜蜂工蜂8 d封盖子低温处理96 h的样本进行转录组测序(RNA-seq),探索蜜蜂蛹中期在基因表达层面上可能存在的低温应对机制,以及低温对其发育仍存在哪些不利影响。研究温度对蜜蜂发育的影响,有助于理解低温胁迫对狭温性昆虫的影响以及狭温性昆虫适应低温环境的机制。养蜂生产中,开箱检查、子脾调整、蜂群合并以及蜂王浆生产需移虫操作,均可能出现低温影响蜂子发育的状况。探索低温对蜂子发育的影响,有利于指导改进蜜蜂饲养管理技术(Aizen and Harder, 2009)。
1.1 供试蜜蜂
测序样本取自西方蜜蜂蜂群,取样时间为春季2021年4-6月蜂群增长阶段,通过隔王栅限王产卵,获得卵龄一致的蜜蜂卵。将卵脾放入哺育群哺育,以获得发育良好且一致的封盖子。移入哺育群5 d后大幼虫即将封盖,取4 h内封盖的封盖子,割取封盖巢脾,在恒温恒湿箱35±0.2℃(RH 75%)[CTHI-250B, 施都凯仪器设备(上海)有限公司, 精度±0.1℃]中培育8 d作为对照组,记作CK。再将8 d封盖子(蛹中期)放入低温20℃(±0.2℃, RH 75%)(Wangetal., 2016)进行96 h处理为处理组,记作T。低温处理后的封盖子样本立即用液氮冷冻,放入-80℃保存备用。每个蜂群采集样本10头,3群作为3个生物学重复进行转录组测序分析。
1.2 转录组高通量测序及测序数据质量评估
委托广州基迪奥生物科技有限公司完成构建cDNA文库以及高通量测序,测序平台为Illumina HiSeqTM。对下机数据的原始读段(raw reads)进行过滤,去除含接头的读段(reads)、含N比例大于10%的读段和低质量的读段,最终得到高质量读段(clean reads)(Chenetal., 2018),然后利用Tophat2(2.1.1)软件将读段比对到西方蜜蜂的参考基因组上Amel_HAv3.1(NCBI Assembly: GCF_003254395.2),并利用Cufflinks组装转录本。转录组原始数据已上传NCBI的SRA数据库(获取号: SRR15710549-SRR15710554)。
1.3 DEGs的筛选及其GO及KEGG富集分析
使用DESeq2软件对生物学重复的处理组与对照组间进行DEGs分析(Loveetal., 2014),DEGs筛选条件为|log2FC|≥1 (FC, fold change, 指基因表达水平的变化, FC=T/CK, 其中T为处理组的基因表达水平, CK为对照组的基因表达水平),错误发现率(false discovery rate, FDR)≤0.05。对CKvsT的DEGs进行GO功能和KEGG通路注释及富集分析(Omicshare Tools, http:∥www.omicshare. com/tools/home/index/index.html)。FDR≤0.01为差异极显著基因。
1.4 DEGs的RT-qPCR验证
为验证RNA-Seq数据的可靠性,从DEGs中随机挑选了5个DEGs,即二氢嘧啶酶(dihydropyrimidinase, DPYS)基因、丝氨酸/苏氨酸蛋白激酶(UNC-51-like kinase 3, ULK3)基因、过氧化物酶体酰基辅酶A氧化酶3(peroxisomal acyl-coenzyme A oxidase 3, ACOX3)基因、叉头框蛋白(forkhead box protein O, FoxO)基因和脂肪酰基辅酶A还原酶CG5065(putative fatty acyl-CoA reductase CG5065, FACRCG5065)基因,进行RT-qPCR验证并利用NCBI Primer Blast设计引物(表1)。从3个蜂群再次取样,取样方法同1.1节。每个样本设置3个蜂群的生物学重复和3次技术重复。利用全式金生物科技有限公司的Transzol Up Plus RNA Kit试剂盒提取样本总RNA,利用反转录试剂盒合成cDNA第1链(北京全式金生物技术有限公司)。以上述的cDNA作为模板进行qPCR。qPCR反应体系(20 μL): H2O 6.6 μL, 2×TransStart SuperMix 10 μL, 上下游引物(5 μmol/L)各1 μL, cDNA模板1 μL, Dye II 0.4 μL。qPCR反应程序: 95℃预变性30 s; 95℃变性5 s, 60℃退火和延伸30 s, 共40 个循环;
熔解曲线默认系统程序95℃ 5 s; 60℃ 30 s; 95℃ 1 s(QuantStudio5, 美国)。以Actin作为内参基因。

表1 引物信息
1.5 数据分析
RT-qPCR实验基因的表达水平按照2-ΔΔCt法进行计算(Livak and Schmittgen, 2001),每个目的基因进行3次生物学重复和3次技术重复,取平均值,并计算数据标准差;
应用SPSS V21.0软件对RT-qPCR实验处理组与对照组之间平均相对表达量的差异显著性进行非配对T检验。RT-qPCR数据结果在与RNA-Seq测序数据对比时,先经过log2(平均值)的转换。
2.1 测序结果质量评估
通过对CK和T测序,分别得到原始读段平均为51 929 304.67和51 198 348.67,过滤后得到高质量有效读段平均分别为50 122 846和50 803 814。统计两端的Q20和Q30平均分别在98.20%和94.85%以上,表明本研究测序数据质量良好,可用于进一步分析。
2.2 低温胁迫后的DEGs
8 d封盖子20℃低温胁迫96 h后,CKvsT间DEGs总数为1 101个,上调基因总数为330个,下调基因总数771个,下调基因数大于上调基因数。
2.3 DEGs的GO功能和KEGG通路注释及富集分析
对获得DEGs的GO功能注释和富集分析结果表明,DEGs主要富集在生物学过程(biological process)(518个),分子功能(molecular function)(307个)和细胞组分(cellular components)(276个)3大类的27个二级GO条目上,其中基因富集数最多的是代谢过程(metabolic process)(142个)和细胞进程(cellular process)(142个),其次是结合(binding)(131个)、催化活性(catalytic activity)(120个)和单有机体过程(single organism process)(118个)。上调基因富集最多的为结合(45个),其次是细胞进程(43个)和代谢过程(41个);
下调基因富集最多的为代谢过程(101个)和细胞进程(99个),其次是单有机体过程(92个)和结合(86个)。在不同的GO条目上下调基因数均多于上调基因数(图1)。

图1 低温胁迫西方蜜蜂工蜂8 d封盖子DEGs的GO分类
KEGG通路注释和富集分析结果显示,DEGs富集的通路分为细胞进程(30个)、环境信息加工(environmental information processing)(30个)、遗传信息加工(genetic information processing)(49个)、代谢(metabolism)(456个)、有机体系统(organismal system)(9个)5大类(图2);
DEGs富集在113个通路上,富集数排在前10的全部富集于代谢模块,其中富集数最多通路的是代谢通路(signaling pathway)(99个),其次是次生代谢物的生物合成(biosynthesis of secondary metabolites)(36个)、抗生素的生物合成(antibiotic biosynthesis)(26个)、 微生物在不同环境中的代谢(metabolism of microorganism in different environments)(24个)、碳代谢(carbon metabolism)(15个)、嘌呤代谢(purine metabolism)(13个)、氨基糖和核苷酸糖代谢(amino sugar and nucleotide sugar metabolism)(12个)、脂肪代谢(lipid metabolism)(11个)、氨基酸的生物合成(biosynthesis of amino acids)(11个)。与抗氧化系统相关的过氧化物酶体通路差异极显著基因数有10个,均下调表达,其中控制短链脱氢酶家族成员4(DHRS4)合成的相关基因有两个(LOC100577607和LOC412304);
控制脂酰辅酶A还原酶合成相关的基因有3个(LOC100576414,LOC100578329和LOC725187)。而与谷胱甘肽相关的D-谷氨酰胺和D-谷氨酸代谢通路、谷胱甘肽代谢通路上的谷氨酸脱氢酶基因(LOC409253)和谷胱甘肽S-转移酶基因(LOC552283)下调表达。与发育密切相关的昆虫激素代谢通路中,控制合成保幼激素环解酶基因(JHEH)下调表达,mTOR信号通路控制合成丝氨酸/苏氨酸蛋白激酶基因(ULK3)下调表达,且FoxO信号通路叉头框蛋白基因(FoxO)及胰岛素受体基因(INSR)上调表达(表2)。
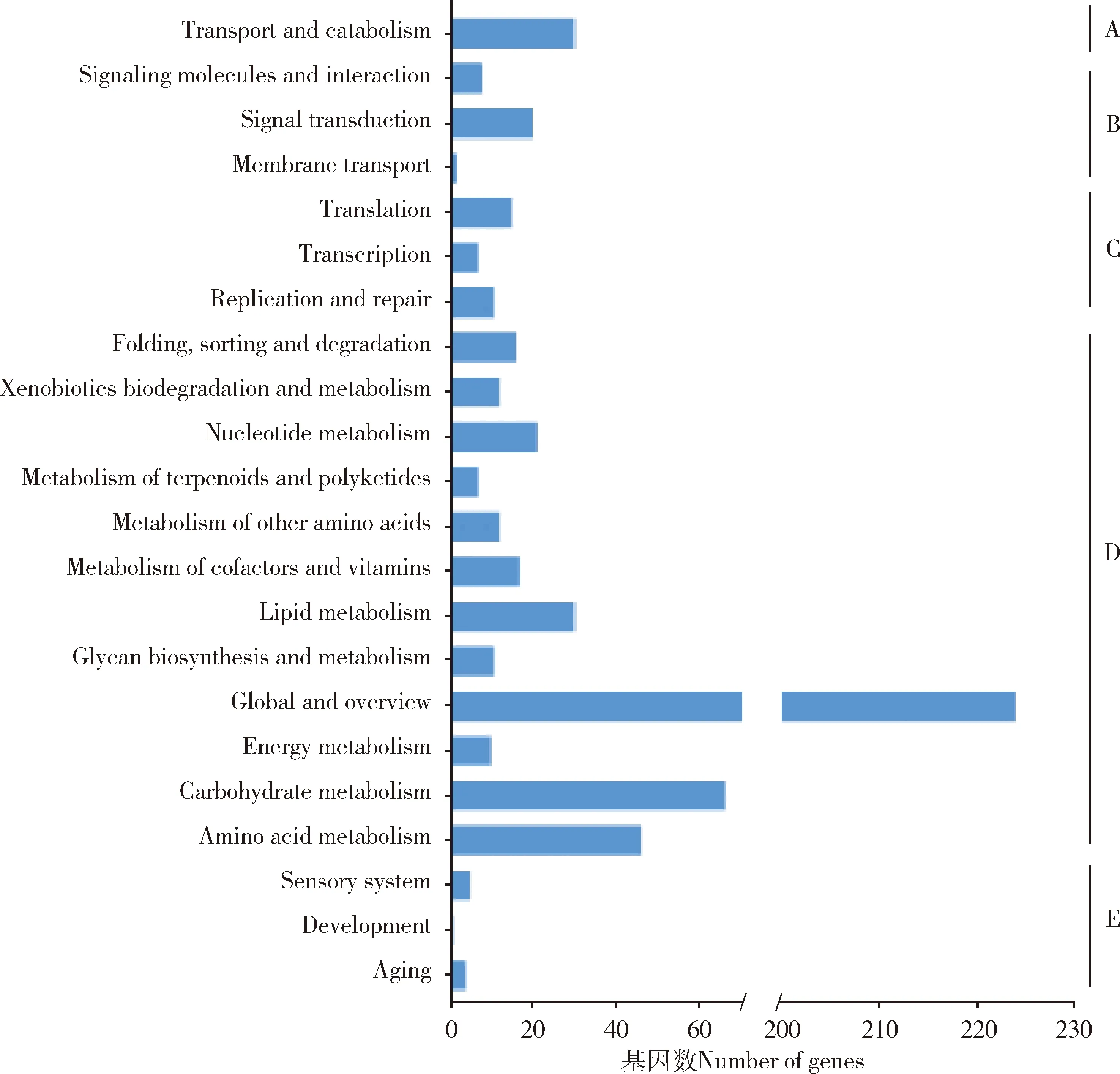
图2 低温胁迫西方蜜蜂工蜂8 d封盖子DEGs的KEGG 通路分析
2.4 DEGs的RT-qPCR验证
为验证测序数据的可靠性,选取5个DEGs的表达量进行RT-qPCR定量检测,结果与对应的转录组测序结果中这些差异基因的趋势一致。RNA测序结果的基因表达水平变化趋势一致,证实RNA测序结果可信(图3)。
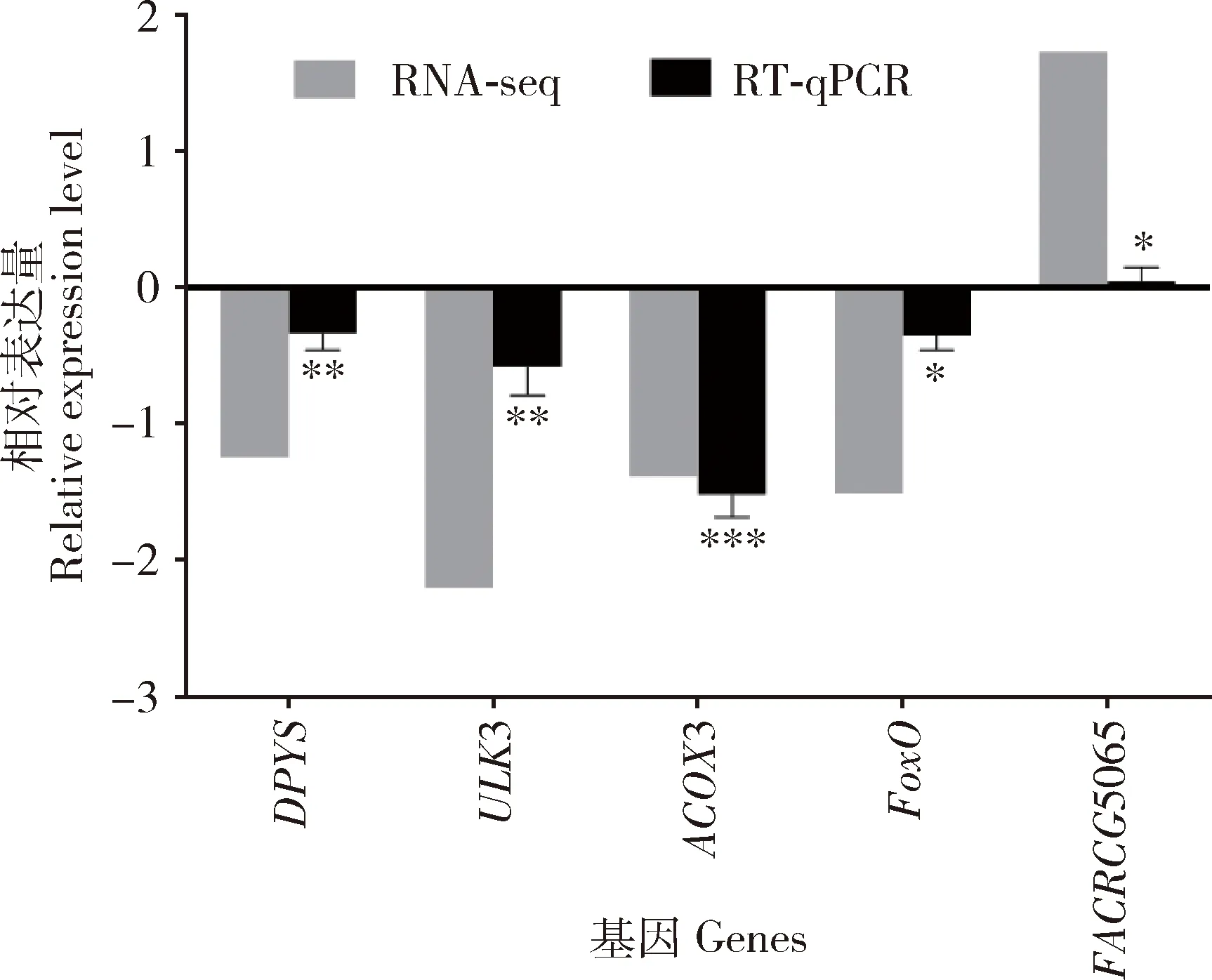
图3 低温胁迫西方蜜蜂工蜂8 d封盖子DEGs的RNA-Seq测序数据的RT-qPCR验证
本研究发现,低温胁迫可导致调控发育系统发生异常,可能是蜜蜂蛹发育停滞或减缓的原因,封盖子以此降低代谢,降低能量消耗,保存实力应对低温带来的不良影响;
同时低温胁迫可能影响谷胱甘肽代谢、过氧化物酶体等影响抗氧化水平,蜜蜂蛹累积氧化损伤,从而羽化蜜蜂受到影响;
蜜蜂蛹中期低温胁迫,蜜蜂蛹发育停滞或减缓以应对低温带来的不良影响,可能与保幼激素(JH)降解受到影响,蜕皮激素(20E)合成减少,FoxO磷酸化,细胞自噬被抑制等系列变化有关。蜜蜂的生长发育由20E和JH及胰岛素等多种激素共同调控的(Pursleysetal., 2000; Wangetal., 2013),激素的滴度变化共同诱导着蜜蜂的发育过程(刘川冬等, 2017)。研究结果显示差异表达基因保幼激素环解酶基因(JHEH)下调表达(表2),另一方面,FoxO基因上调表达(表2),FoxO与JHEH启动子序列结合,可抑制JHEH表达(Zengetal., 2017),这两个基因的差异表达均可导致与JH降解相关的JHEH的合成减少。JHEH的作用是降解JH(Zhangetal., 2005; Tsubotaetal., 2010),调控JH滴度降低。因此推测低温胁迫导致JH的降解受到影响,JH滴度与正常发育个体相比相对较高,有助于蜜蜂发育维持现状。我们还发现低温处理后参与20E合成的基因P450302a1(Dib)(Chávezetal., 2000)下调表达(表2),同时,JH滴度相对较高也会抑制20E合成(Gaoetal., 2022),这说明低温胁迫封盖子会使20E合成减少。低温处理后胰岛素受体基因(INSR)上调表达(表2),INSR具有磷酸化FoxO蛋白的功能,FoxO蛋白如果发生磷酸化就无法入核,而留在细胞质被降解。昆虫在发育过程中,FoxO蛋白具有启动蜕皮激素下游初级应答基因Br-C传递蜕皮信号和发挥皮层融离作用(Heeetal., 2012; Süren-Castilloetal., 2012; Caietal., 2016),是蜕皮激素发挥功能的重要环节(Gonzyetal., 2002)。说明低温抑制了蜕皮激素功能,从而发育缓慢或停止发育。这与本团队对低温处理蜜蜂化蛹期封盖子转录组进行分析发现胰岛素类似物基因(ILP)的表达量上调会导致FoxO磷酸化后无法激活20E下游基因(姚丹等, 2020)相似,说明在不同发育阶段低温胁迫均会造成FoxO磷酸化,但其上游的胰岛素信号通路中差异基因不同。此外,还检测到mTOR信号通路丝氨酸/苏氨酸蛋白激酶基因(ULK3)下调表达。mTOR信号通路是生长调节的重要环节,mTOR通路主要通过生长因子,胰岛素与胰岛素样生长因子(IGF)和氨基酸和葡萄糖营养来调节细胞生长,参与细胞自噬(Sarkaretal., 2007; Yang and Guan, 2007)。而此酶在细胞自噬过程中发挥重要作用,介导自噬的起始(Russelletal., 2013),ULK3基因表达受到低温影响后,细胞自噬也将受到不同程度的影响。因此,低温胁迫影响蛹中期的细胞自噬而使蜜蜂发育减缓。

表2 低温胁迫西方蜜蜂工蜂8 d封盖子的DEGs与发育及抗氧化相关的KEGG通路
蜜蜂发育阶段通过激素调控停止或减缓发育,而非抗寒小分子物质积累或抗冻蛋白来度过低温环境。很多昆虫处于低温环境中时,积累小分子物质以抵御低温环境(Baustetal., 1984; 欧阳芳和戈峰, 2014)。昆虫利用小分子物质积累及抗冻蛋白(AFPs)使冰点及过冷却点降低以抵御低温,利用热激蛋白(HSPs)恢复肽链功能。沙葱萤叶甲Galerucadaurica虫体内抗寒系统为小分子碳水化合物-氨基酸类-脂肪(李浩等, 2014);
二化螟Chilosupperssalis滞育幼虫以蛋白质及小分子糖类积累来抵御低温(张拥军, 2007)。AFPs通过与冰晶不可逆结合降低昆虫过冷却点,云杉蚜虫等昆虫利用AFPs越冬(周艳霞等, 2006)。HSPs可促进低温影响的细胞内肽链重新折叠恢复功能,叶蝉在-7.5~-5℃下hsp20及hsp70表达量上升以抵御低温(Huangetal., 2007)。发育过程中的昆虫多通过滞育或休眠的方式抵御低温,这一过程中主要涉及滞育激素(DH)和JH来调控发育。家蚕Bombyxmori卵期通过DH的作用将体内海藻糖转化为葡萄糖,通过小分子糖类物质积累抵御低温;
熊蜂蜂王主要通过JH滴度调控卵巢活性使发育停滞(Fueusawaetal., 1999; Hartfelder, 2000)。本研究未发现HSP, AFP和DH基因差异表达,且正常工蜂不参与生殖,这说明处于发育阶段的蜜蜂工蜂具有狭温性,与其他昆虫具有不同的抵御低温机制,这种机制可能是狭温性昆虫所特有的。
低温引起蛹中期工蜂抗氧化酶表达量下降,这可能会导致氧化还原平衡被破坏,内部氧化水平升高,从而积累氧化损伤。在本研究中蜜蜂蛹中期经过长时间低温胁迫后,进行差异表达基因的KEGG分析,结果显示谷胱甘肽代谢通路谷胱甘肽脱氢酶基因(GDH)、谷胱甘肽硫转移酶基因(GST)以及过氧化物酶体通路短链脱氢酶家族成员4基因(DHRS4)均下调表达(表2),这些基因均与抗氧化相关。谷胱甘肽代谢相关酶通过使过氧化物失活抑制细胞内活性氧含量,从而维持细胞内氧化还原平衡。GDH位于动植物以及微生物体内的线粒体中,对于细胞内氧化还原平衡起着至关重要的作用(Goldin and Frieden, 1971; Xuetal., 2016)。而GSTs参与调控昆虫的抗逆功能,通过对中华蜜蜂GST基因进行基因沉默后,发现蜜蜂存活率下降,体内氧化水平升高,蜜蜂受到了氧化损伤(Enayatietal., 2005; Mengetal., 2014)。由此推测蜜蜂蛹中期受到低温胁迫会使谷胱甘肽代谢受到影响,引起氧化损伤。此外,辅酶依赖性视黄醛脱氧还原酶(NRDR)作为一种羰基还原酶参与细胞内多种物质的氧化还原反应(张静, 2014),NRDR由DHRS4基因翻译而成(Perssonetal., 1995),存在于吞噬细胞质膜,能生成用于清除病原微生物的活性氧(Steck and Grassl, 2014)。低温胁迫后封盖子体内控制NRDR合成的基因下调表达时,抗氧化酶作用受到影响,细胞可能积累氧化损伤。
低温状况下昆虫需要抗氧化酶系统相关基因高表达以抵御低温带来的氧化损伤。昆虫体内的抗氧化酶主要包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD) (李周直等, 1994)。本研究结果显示发育阶段的蜜蜂抗氧化酶系统与成蜂及其他昆虫不同,主要为谷胱甘肽脱氢酶(GDH)、谷胱甘肽还原酶(GR)和谷胱甘肽S-转移酶(GSTs)等。荒漠昆虫小胸鳖甲Microderapunctipennis在低温条件下抗氧化酶基因SOD高表达(肖荣, 2015);
西藏飞蝗在低温条件下体壁与消化道的抗氧化酶SOD, POD和CAT活性增强,以维持虫体氧化水平(吴蕾, 2010);
小金蝠蛾Hepialusxiaojinensis幼虫受低温影响4 h后,体内丙二醛(MDA)含量增加,其GSTs活性增强(张青等, 2016)。从这些研究结果看出,一方面对低温耐受能力强的昆虫抗氧化酶种类与蜜蜂蛹中期不同,另一方面这些昆虫通过抗氧化酶基因上调表达提高抗氧化能力,而有研究表明越冬期中华蜜蜂体内磷酸海藻糖合成酶(TPS)及SOD基因表达水平随低温胁迫时间延长先升高后降低(夏振宇等, 2019),结合本研究中抗氧化酶表达量下降,96 h的低温处理强度超出蜜蜂抗氧化能力,推测其他昆虫延长低温处理时间也会和蜜蜂一样出现抗氧化酶表达量下降的现象,但这个时间可能需要很长。
- 范文大全
- 说说大全
- 学习资料
- 语录
- 生肖
- 解梦
- 十二星座
-
主题党日活动交流发言8篇
主题党日活动交流发言8篇主题党日活动交流发言篇13月13日,东城区党史学习教育动员大会召开。市委
【活动总结】 日期:2022-12-23
-
2022年4月主题党日活动记录范文15篇
2022年4月主题党日活动记录范文15篇2022年4月主题党日活动记录范文篇1一个崇尚阅读的民族,必然精神饱满、意气风发、活力四射。习近平总书记强调:“学习
【活动总结】 日期:2022-08-01
-
家乡赋|最美的家乡赋
家乡赋 孙传志 今安康市,白河双丰镇,吾之家乡也。三环沃土,山水环抱。其北依山,山系五岭,山
【调研报告】 日期:2020-04-01
-
少先队的光荣历史故事 队前教育-光辉历程
2017-2018学年队前教育1光辉历程一、劳动童子团1924——1927二、三十年代年的中国是一个
【法律文书】 日期:2020-06-23
-
党支部1-12月全年主题党日活动计划表
2022年党支部主题党日活动计划表序号活动时间活动方式活动内容12022年1月专题学习研讨集中观看2022年新年贺词,积极开展学习研讨交流。组织生活会组织党员认真对照党章...
【活动总结】 日期:2022-10-14
-
【人教版1-6年级数学上册知识点精编】1-6年级数学人教版教材
人教版二年级数学上册知识点汇总第一单元长度单位一、米和厘米1、测量物体的长度时,要用统一的标准去测量
【调研报告】 日期:2020-11-08
-
2022年2月份主题党日活动记录5篇
2022年2月份主题党日活动记录5篇2022年2月份主题党日活动记录篇1尊敬的党组织:在今年的开学初,本人积极参加教研室组织的教研活动,在学校教研员的指
【活动总结】 日期:2022-08-12
-
医院最佳主题党日活动11篇
医院最佳主题党日活动11篇医院最佳主题党日活动篇1 医院最佳主题党日活动篇2为隆重纪念中国共产党成立100周年,进一步巩固党的群众路线教育实践活动成果,切实
【活动总结】 日期:2022-10-29
-
2023年平安校园建设方案13篇
平安校园建设方案“平安校园”创建工作,我们幼儿园全体教职员工一直把它当作头等大事来抓。领导高度重视,以“平安校园”创建活动为抓手,建立和规范校园安全工作机制
【规章制度】 日期:2023-11-02
-
主题党日活动记录202210篇
主题党日活动记录202210篇主题党日活动记录2022篇12021年是中国共产党成立100周年,为广泛开展爱国主义宣传教育,铭记党的历史,讴歌党的光辉历程,
【活动总结】 日期:2022-08-02
-
正式的晚宴邀请函 公司晚宴邀请函
尊敬的先生 女士: 我公司谨定于xxxx年xx月xx日xx:xx在xxxx店隆重举行xx市xx届xxxx晚宴(宴会地址:xx区xx路xxxx) 敬请届时光临!xxxxxx集团股份有限公司xxxx有限公司敬邀xxxx年xx月xx日
【简历资料】 日期:2019-08-03
-
《国行公祭,为佑世界和平》课文原文阅读_国行公祭为佑世界和平每段段意
国行公祭,为佑世界和平钟声“国行公祭,法立典章。铸兹宝鼎,祀我国殇。”侵华日军南京大屠杀遇难同胞纪念
【简历资料】 日期:2020-11-28
-
一年级新学期目标简短_一年级学生新学期打算
新学期到了,我是一年级下册的小学生了。 上课的时候,我要认真学习,不做小动作,认真听讲。我要认真学习,天天向上,努力学习,耳朵要听老师讲课,眼睛要瞪得大大的看老...
【简历资料】 日期:2019-10-26
-
[信访复查复核制度作用探讨]信访复查复核有用吗
作为我国特有的一项制度,信访制度的出现并长期存在不是偶然的,虽然一些法学专家认为信访制度具有“人治”
【职场指南】 日期:2020-02-16
-
[党员干部2019年主题教育个人问题检视清单及整改措施2篇] 党员干部
2019年主题教育问题检视清单及整改措施根据主题教育领导小组办公室《关于认真做好主题教育检视问题整改
【求职简历】 日期:2019-11-08
-
网络维护工作内容_(精华)国家开放大学电大专科《网络系统管理与维护》形考任务1答案
国家开放大学电大专科《网络系统管理与维护》形考任务1答案形考任务1理解上网行为管理软件的功能【实训目
【职场指南】 日期:2020-07-17
-
红旗颂朗诵稿原文【《红旗颂》朗诵词】
《红旗颂》朗诵词 女:晴空万里,红旗飘扬, 六十载风云,我们昂首阔步。 男:六十个春秋,
【职场指南】 日期:2020-02-16
-
党委会与局长办公会的区别_局长办公会制度
为进一步加强xxx局工作的规范化、制度化建设,提高行政效能,规范议事程序,特制定本制度。一、会议形式1、局长办公会议由局长、副局长参加。由局长召集和主持。根据工作需要...
【求职简历】 日期:2019-07-30
-
《铁拳砸碎“黑警伞”》警示教育片观后感
影片深刻剖析了广西北海市公安局海西派出所原所长张枭杰蜕变堕落的轨迹。观看警示教育片后,做为一名党员教
【简历资料】 日期:2020-08-17
-
如何凝心聚力谋发展【坚定信心谋发展凝心聚力促跨越】
当前,清河正处于在苏北实现赶超跨越基础上全面腾飞的战略机遇期,处于在全市率先实现全面小康基础上率先实
【简历资料】 日期:2020-03-17
-
2022用数字写出“高大上”材料(全文完整)
一、要解决好三个问题一要解决好戒镀金、专炼金的问题。匆匆过客如云烟,留不下一丝挂牵。基层工作人员要坚决摒弃镀金思想,专于炼金,将淬火成钢理念根植灵魂深处。炼金不可...
【其他范文】 日期:2022-09-06
-
纪委书记在干部任前提醒谈话会上的讲话
下面是小编为大家整理的纪委书记在干部任前提醒谈话会上的讲话
【其他范文】 日期:2022-08-19
-
竹子联通世界,创享低碳未来2022,中国国际竹产业交易博览会在四川青神举办
中国竹产业协会2022中国国际竹产业交易博览会现场2022中国国际竹产业交易博览会隆重开幕12月9日
【其他范文】 日期:2023-03-27
-
专题组织生活会具体要求 专题组织生活会
专题组织生活会具体要求近日,我局对即将召开的专题组织生活会作了专题部署,明确了会前、会中、会后各环节
【其他范文】 日期:2020-08-21
-
在中心城市打赢蓝天保卫战专项整治行动动员大会上的讲话(范文推荐)
下面是小编为大家整理的在中心城市打赢蓝天保卫战专项整治行动动员大会上的讲话
【其他范文】 日期:2022-08-08
-
生长激素缺乏症患儿血清IGF-1、Apelin、25(OH)D水平及与生长激素的相关性
向静瑶,王晓瑜,徐开渝,邓全敏生长激素缺乏症是指由于下丘脑、垂体缺陷引起垂体生长激素分泌异常,患儿出
【其他范文】 日期:2023-01-12
-
早熟高产大豆品种合农95选育及配套栽培技术*
张茂明(黑龙江省农业科学院佳木斯分院 三江平原主要作物育种栽培重点实验室,黑龙江佳木斯154007)
【其他范文】 日期:2023-01-27
-
【新建实用气体生产建设项目试生产方案】
XX气体有限公司新建实用气体生产建设项目试生产方案XX气体有限公司二0一二年X月目录一、概述。。。。
【其他范文】 日期:2020-09-29
-
华蟾素联合三阶梯止痛法治疗癌痛的疗效及安全性Meta,分析
袁佳倩郭勇癌症已成为严重威胁人类健康的一类疾病,在近50%的癌症患者及超过70%的晚期癌症患者中癌痛
【其他范文】 日期:2023-06-28
-
国企党委书记在2022年度党风廉政建设和反腐败工作会议上的讲话
下面是小编为大家整理的国企党委书记在2022年度党风廉政建设和反腐败工作会议
【其他范文】 日期:2022-10-16
-
理论中心组学习总体国家安全观发言材料9篇
理论中心组学习总体国家安全观发言材料9篇理论中心组学习总体国家安全观发言材料篇1(八)深入学习贯彻中央以及省的重要会议和文件精神深入学习贯彻年度内中央以
【发言稿】 日期:2022-08-04
-
军转座谈会交流发言4篇
军转座谈会交流发言4篇军转座谈会交流发言篇1大家好,我叫贺丽,2015届选调生,来自康定市委组织部,现在省委编办跟班学习。今天,非常荣幸向大家汇报我的学习收
【发言稿】 日期:2022-10-27
-
12岁生日小寿星发言4篇
12岁生日小寿星发言4篇12岁生日小寿星发言篇1各位来宾、各位朋友:大家好!今天,我们欢聚在这里,共同庆祝**十二周岁生日。首先,我代表**的父母以
【发言稿】 日期:2022-07-31
-
党内警告处分表态发言14篇
党内警告处分表态发言14篇党内警告处分表态发言篇1尊敬的各位领导、同事们:大家上午好!刚才会上宣布了党委关于我任职的决定,我首先衷心感谢党委的信任和
【发言稿】 日期:2022-09-13
-
党内警告处分党员讨论发言3篇
党内警告处分党员讨论发言3篇党内警告处分党员讨论发言篇1大家好!作为新时期的一名大学生,认真学习、深刻领会、全面贯彻省党代会精神,是当前和今后一个时期重
【发言稿】 日期:2022-08-07
-
廉政大会总结发言稿7篇
廉政大会总结发言稿7篇廉政大会总结发言稿篇1各位领导,同志们:根据会议安排,我就党风廉政建设工作做表态发言,不妥之处,请批评指正。一、提高认识,切实
【发言稿】 日期:2022-10-30
-
被约谈的表态发言8篇
被约谈的表态发言8篇被约谈的表态发言篇1各位领导、各位党员大家好:这天我能站在鲜红的党旗下,
【发言稿】 日期:2022-12-24
-
破冰提能大讨论个人发言4篇
破冰提能大讨论个人发言4篇破冰提能大讨论个人发言篇1党史学习教育开展以来,我坚持读原著、学原文、悟原理。今天,根据会议安排,现在我就“学史明理”主题谈几点个
【发言稿】 日期:2022-10-09
-
巡察整改专题民主生活会总结发言8篇
巡察整改专题民主生活会总结发言8篇巡察整改专题民主生活会总结发言篇1按照区委统一部署和纪监委、巡察办关于召开党史学习教育专题组织生活会的工作安排,近期我紧贴
【发言稿】 日期:2022-10-12
-
纪委书记工作表态发言4篇
纪委书记工作表态发言4篇纪委书记工作表态发言篇1在镇党委政府正确领导下,在全村干部和群众的共同努力下,紧紧围绕建设社会主义新农村工作为重点,尽职尽责,与时俱
【发言稿】 日期:2022-09-30
-
学习周永开先进事迹心得体会3篇
学习周永开先进事迹心得体会【一】通过学习周永开老先生先进事迹后,结合自己工作思考,感慨万千。同样作为
【格言】 日期:2021-04-10
-
最满意的三项工作200字【最新党办公务员副主任提拔考察个人三年思想工作总结报告】
党办公务员个人三年工作总结近三年来,本人在组织、领导的关心指导和同事们的团结协作下,尽快完成主角的转
【格言】 日期:2021-02-26
-
XX老干局推进党建与业务深度融合发展工作情况调研报告:党建调研报告
XX老干局推进党建与业务深度融合 发展工作情况的调研报告 党建工作与业务工作融合发展始终是一个充满生
【成语大全】 日期:2020-08-28
-
中国共产党第三代中央领导集体的卓越贡献
中国共产党第三代中央领导集体的卓越贡献 --------------继往开来铸就辉煌 【摘要】改
【成语大全】 日期:2020-03-20
-
信息技术2.0能力点 [全国中小学教师信息技术应用能力提升工程试题题库及参考答案「精编」]
全国中小学教师信息技术应用能力提升工程试题题库及答案(复习资料)一、判断题题库(A为正确,B为错误)
【格言】 日期:2020-11-17
-
党建工作运行机制内容有哪些_构建基层党建工作运行机制探讨
党的基层组织是党在社会基层组织中的战斗堡垒,是党的全部工作和战斗力的基础。加强和改进县级以下各类党的
【经典阅读】 日期:2020-01-22
-
电大现代教育原理_最新国家开放大学电大《现代教育原理》形考任务2试题及答案
最新国家开放大学电大《现代教育原理》形考任务2试题及答案形考任务二一、多项选择题(共17道试题,共3
【成语大全】 日期:2020-07-20
-
集合推理_七,推理与集合
七推理与集合1 期中考试数学成绩出来了,三个好朋友分别考了88分,92分,95分。他们分别考了多少分
【名人名言】 日期:2020-12-18
-
基层党务工作基本内容_党建基本工作有哪些
党建基本工作有哪些(一) 基层党建工作包括哪些内容 选择了大学生村官这条路,你就与农村基层党
【名人名言】 日期:2020-08-06
-
[人生赠言]城隍庙人生赠言注释
人之相惜惜于品,人之相敬敬于德,人之相交交于情,人之相随随于义,人之相拥拥于礼,人之相信信于诚,人之相伴伴于爱! 人生的确很累,看你如何品味,每天多寻欢乐,烦...
【格言】 日期:2019-07-14
-
关于三农工作重要论述心得体会3篇
关于三农工作重要论述心得体会3篇关于三农工作重要论述心得体会篇1习近平总书记指出:“建设现代化国家离不开农业农村现代化,要继续巩固脱贫攻坚成果,扎实推进乡村
【学习心得体会】 日期:2022-10-29
-
【福生庄隧道坍塌处理方案】 福生庄隧道在哪里
(呼和浩特铁路局大包电气化改造工程指挥部,内蒙古呼和浩特010050)摘要:文章介绍了福生庄隧道
【学习心得体会】 日期:2020-03-05
-
五个一百工程阅读心得体会13篇
五个一百工程阅读心得体会13篇五个一百工程阅读心得体会篇1凡益之道,与时偕行。在全国网络安全和信
【学习心得体会】 日期:2022-12-07
-
城管系统警示教育心得体会9篇
城管系统警示教育心得体会9篇城管系统警示教育心得体会篇1各党支部要召开多种形式的庆七一座谈会,组织广大党员进行座谈,回顾党的光辉历程,畅谈党的丰功伟绩,
【学习心得体会】 日期:2022-10-09
-
发展对象培训主要内容10篇
发展对象培训主要内容10篇发展对象培训主要内容篇1怀着无比激动的心情,我有幸参加了__新区区委党校20__年第四期(区级机关)党员发展对象培训班。这次的学习
【培训心得体会】 日期:2022-09-24
-
扶眉战役纪念馆心得体会11篇
扶眉战役纪念馆心得体会11篇扶眉战役纪念馆心得体会篇1有那么一段历史,低诉着血和泪的故事,慢慢地,随岁月老去;有那么一群人,放弃了闲逸的人生,辗转奔波中
【学习心得体会】 日期:2022-08-03
-
凝聚三种力量发展全过程人民民主心得体会12篇
凝聚三种力量发展全过程人民民主心得体会12篇凝聚三种力量发展全过程人民民主心得体会篇1新民主主义革命是指在帝国主义和无产阶级革命时代,殖民地半殖民地国家中的
【学习心得体会】 日期:2022-08-31
-
2022年全国检察长会议心得7篇
2022年全国检察长会议心得7篇2022年全国检察长会议心得篇1眼睛是心灵上的窗户,我们通过眼睛才能看到世间万物,才能看到眼前这美好的一切。拥有一双明亮的眼
【学习心得体会】 日期:2022-10-31
-
全面从严治党的心得体会800字7篇
全面从严治党的心得体会800字7篇全面从严治党的心得体会800字篇1中国特色社会主义是我们党领导
【学习心得体会】 日期:2022-12-14
-
教师全国两会精神学习专题研讨交流材料6篇
教师全国两会精神学习专题研讨交流材料6篇教师全国两会精神学习专题研讨交流材料篇1通过对两会精神深入系统的学习,作为新一代的青年人,更应该严格要求自己,贯彻落
【教师心得体会】 日期:2022-08-11
-
 2024年主题教育民主生活会批评与自我批评意见(38条)(范文推荐)
2024年主题教育民主生活会批评与自我批评意见(38条)(范文推荐)
2023年主题教育民主生活会六个方面个人检视、相互批评意见:1 理论学习系统性不强。学习习近平新时代中国特色社会主义思想不深不透,泛泛而学的时候多,深学细照的时候少,特...
【邓小平理论】 日期:2024-03-19
-
 2024年交流发言:强化思想理论武装,增强奋进力量(完整)
2024年交流发言:强化思想理论武装,增强奋进力量(完整)
习近平总书记指出:“一个民族要走在时代前列,就一刻不能没有理论思维,一刻不能没有思想指引。”党的十八大以来,伴随着新时代中国特色社会主义思想在实践中形成发展的历程...
【三个代表】 日期:2024-03-19
-
 2024年度镇年度县乡人大代表述职评议活动总结
2024年度镇年度县乡人大代表述职评议活动总结
xx镇20xx年县乡人大代表述职评议活动总结为响应县级人大常委会关于开展县乡两级人大代表述职评议活动,进一步激发代表履职活力,加强代表与人民群众的联系,提高依法履职水平...
【马克思主义】 日期:2024-03-19
-
 “千万工程”经验学习体会(研讨材料)
“千万工程”经验学习体会(研讨材料)
“千万工程”是总书记在浙江工作时亲自谋划、亲自部署、亲自推动的一项重大决策,也是习近平新时代中国特色社会主义思想在之江大地的生动实践。20年来,“千万工程”先后经历...
【三个代表】 日期:2024-03-19
-
 2024年在市政协机关工作总结会议上讲话
2024年在市政协机关工作总结会议上讲话
同志们:刚才,XX同志对市政协机关20XX年工作进行了很好的总结,很精炼,很到位,可以感受到去年机关工作确实可圈可点。XX同志宣读了表彰决定,机关优秀人员代表、先进集体代...
【邓小平理论】 日期:2024-03-18
-
 在全区防汛防涝动员暨河长制工作推进会上讲话提纲【完整版】
在全区防汛防涝动员暨河长制工作推进会上讲话提纲【完整版】
区长,各位领导,同志们:汛期已经来临,我区城区防涝工作面临强大考验,形势不容乐观。年初,区城区防涝排渍指挥部已经召开专题调度会,修订完善应急预案,建立网格化管理机...
【马克思主义】 日期:2024-03-18
-
 2024年镇作风整治工作实施方案(完整文档)
2024年镇作风整治工作实施方案(完整文档)
XX镇作风整治工作实施方案为深入贯彻落实党的二十大精神及省市区委深化作风建设的最新要求,突出重点推进干部效能提升,坚持不懈推动作风整治工作纵深发展,根据《关于印发《2...
【毛泽东思想】 日期:2024-03-18
-
 2024市优化法治化营商环境规范涉企行政执法实施方案【优秀范文】
2024市优化法治化营商环境规范涉企行政执法实施方案【优秀范文】
xx市优化法治化营商环境规范涉企行政执法实施方案为持续优化法治化营商环境,激发市场主体活力和社会创造力,规范行政执法行为,创新行政执法方式,提升行政执法质效,着力解...
【毛泽东思想】 日期:2024-03-18
-
 2024年度关于开展新一轮思想状况摸底排查工作通知(完整)
2024年度关于开展新一轮思想状况摸底排查工作通知(完整)
关于开展新一轮思想状况摸底排查工作的通知为深入贯彻落实关于各地开展干部职工思想状况大摸底大排查情况上的批示要求和改革教育第二次调度会议精神,有针对性做好队伍教育管...
【三个代表】 日期:2024-03-18
-
 2024年公路养护中心主任典型事迹材料(完整文档)
2024年公路养护中心主任典型事迹材料(完整文档)
“中心的工作就是心中的事业”——公路养护中心主任典型事迹材料**,男,1976年6月出生,1993年参加工作,2000年4月调入**区交通运输局工作,大学本科学历,中共党员,现任**...
【马克思主义】 日期:2024-03-17
